
Eigenschaften, Struktur, Hybridisierung der Kohlenstoffatome

Das Kohlenstoffatom es ist vielleicht das wichtigste und emblematischste aller Elemente, denn dank ihm ist die Existenz des Lebens möglich. Es schließt nicht nur einige wenige Elektronen oder einen Kern mit Protonen und Neutronen in sich ein, sondern auch Sternstaub, der eingebaut wird und Lebewesen bildet.
Ebenso finden sich Kohlenstoffatome in der Erdkruste, obwohl sie nicht in einer Menge vorhanden sind, die mit metallischen Elementen wie Eisen, Carbonaten, Kohlendioxid, Öl, Diamanten, Kohlenhydraten usw. vergleichbar ist. Sie sind Teil ihrer physikalischen und chemischen Manifestationen.
Aber wie ist das Kohlenstoffatom? Eine erste ungenaue Skizze ist die im obigen Bild gezeigte, deren Eigenschaften im folgenden Abschnitt beschrieben werden.
Kohlenstoffatome laufen durch die Atmosphäre, die Meere, den Untergrund, Pflanzen und alle Tierarten. Seine große chemische Vielfalt beruht auf der hohen Stabilität seiner Bindungen und der Art und Weise, wie sie im Raum angeordnet sind. So gibt es einerseits weichen und schmierenden Graphit; und auf der anderen Seite der Diamant, dessen Härte die vieler Materialien übertrifft.
Wenn das Kohlenstoffatom nicht die Eigenschaften hätte, die es charakterisieren, würde die organische Chemie nicht vollständig existieren. Einige Visionäre sehen darin die neuen Materialien der Zukunft durch das Design und die Funktionalisierung ihrer allotropen Strukturen (Kohlenstoffnanoröhren, Graphen, Fullerene usw.)..
Artikelverzeichnis
- 1 Eigenschaften des Kohlenstoffatoms
- 2 Struktur
- 3 Hybridisierung
- 3.1 sp3
- 3.2 sp2 und sp
- 4 Klassifizierung
- 4.1 Primär
- 4.2 Sekundär
- 4.3 Tertiär
- 4.4 Quartär
- 5 Verwendungen
- 5.1 Atommasseneinheit
- 5.2 Kohlenstoffkreislauf und Lebensdauer
- 5.3 13C-NMR-Spektroskopie
- 6 Referenzen
Eigenschaften des Kohlenstoffatoms
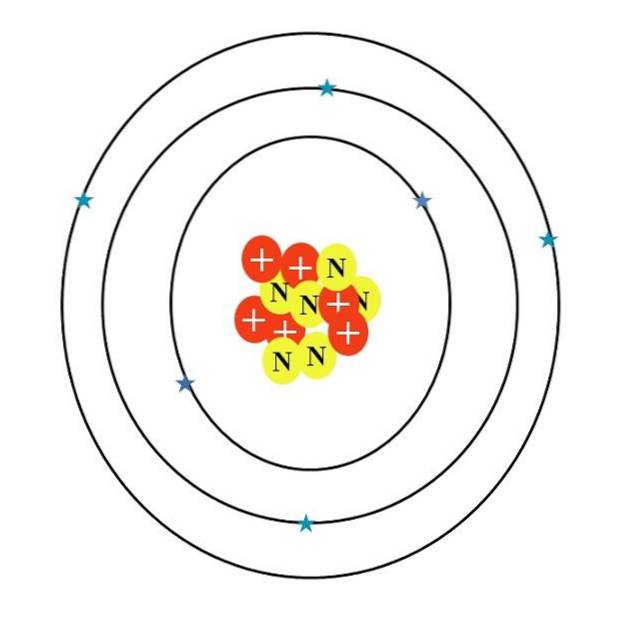
Das Kohlenstoffatom wird durch den Buchstaben C symbolisiert. Seine Ordnungszahl Z ist 6, daher hat es sechs Protonen (rote Kreise mit dem Symbol "+" im Kern). Außerdem hat es sechs Neutronen (gelbe Kreise mit dem Buchstaben "N") und schließlich sechs Elektronen (blaue Sterne)..
Die Summe der Massen seiner Atomteilchen ergibt einen Durchschnittswert von 12,0107 u. Das Atom im Bild entspricht jedoch dem Kohlenstoff-12-Isotop (12C), bestehend aus d. Andere Isotope wie 13C und 14C, weniger häufig, variiert nur in der Anzahl der Neutronen.
Wenn also diese Isotope gezeichnet würden, wäre das 13C hätte einen zusätzlichen gelben Kreis und die 14C, noch zwei. Dies bedeutet logischerweise, dass es sich um schwerere Kohlenstoffatome handelt..
Welche weiteren Merkmale können diesbezüglich zusätzlich erwähnt werden? Es ist vierwertig, dh es kann vier kovalente Bindungen bilden. Es befindet sich in Gruppe 14 (IVA) des Periodensystems, genauer gesagt in Block p.
Es ist auch ein sehr vielseitiges Atom, das sich mit fast allen Elementen des Periodensystems verbinden kann. insbesondere mit sich selbst bilden sich lineare, verzweigte und laminare Makromoleküle und Polymere.
Struktur
Wie ist ein Kohlenstoffatom aufgebaut? Um diese Frage zu beantworten, müssen Sie zuerst zu seiner elektronischen Konfiguration gehen: 1szwei2szwei2 P.zwei oder [He] 2szwei2 P.zwei.
Daher gibt es drei Orbitale: die Einsenzwei, die 2szwei und die 2pzwei, jeweils mit zwei Elektronen. Dies ist auch im obigen Bild zu sehen: drei Ringe mit jeweils zwei Elektronen (blaue Sterne) (verwechseln Sie die Ringe nicht mit Umlaufbahnen: es handelt sich um Orbitale).
Beachten Sie jedoch, dass zwei der Sterne einen dunkleren Blauton haben als die restlichen vier. Warum? Weil die ersten beiden der inneren Schicht 1s entsprechenzwei oder [He], das nicht direkt an der Bildung chemischer Bindungen beteiligt ist; während die Elektronen der äußeren Hülle, 2s und 2p, dies tun.
Die s- und p-Orbitale haben nicht die gleiche Form, so dass das dargestellte Atom nicht mit der Realität übereinstimmt. zusätzlich zu dem großen Missverhältnis des Abstandes zwischen den Elektronen und dem Kern, der hunderte Male größer sein sollte.
Daher besteht die Struktur des Kohlenstoffatoms aus drei Orbitalen, in denen Elektronen zu verschwommenen elektronischen Wolken "schmelzen". Und zwischen dem Kern und diesen Elektronen gibt es eine Entfernung, die das immense "Vakuum" im Inneren des Atoms offenbart..
Hybridisierung
Es wurde bereits erwähnt, dass das Kohlenstoffatom vierwertig ist. Entsprechend seiner elektronischen Konfiguration sind seine 2s-Elektronen gepaart und die 2p-Elektronen ungepaart:
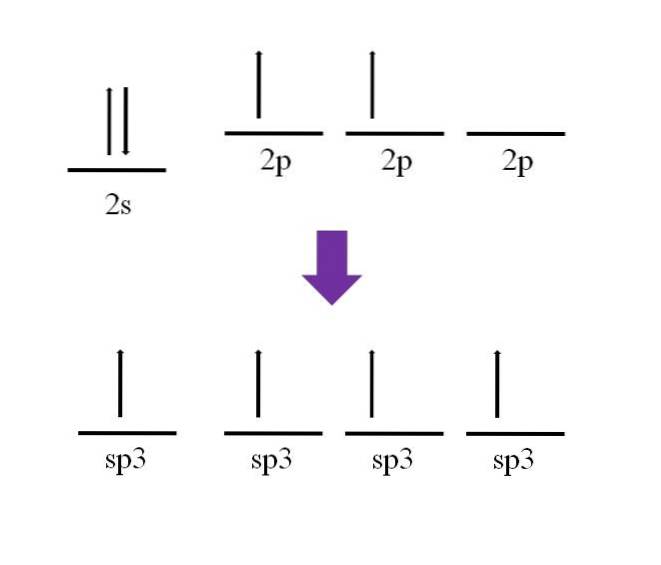
Es steht ein p-Orbital zur Verfügung, das leer und mit einem zusätzlichen Elektron am Stickstoffatom (2p) gefüllt ist3).
Nach der Definition der kovalenten Bindung ist es notwendig, dass jedes Atom ein Elektron zu seiner Bildung beiträgt; es ist jedoch zu sehen, dass in der Grundzustand vom Kohlenstoffatom hat es nur zwei ungepaarte Elektronen (eines in jedem 2p-Orbital). Dies bedeutet, dass es sich in diesem Zustand um ein zweiwertiges Atom handelt und daher nur zwei Bindungen (-C-) bildet..
Wie ist es also möglich, dass das Kohlenstoffatom vier Bindungen bildet? Dazu müssen Sie ein Elektron vom 2s-Orbital zum energiereicheren 2p-Orbital befördern. Wenn dies erledigt ist, sind die resultierenden vier Orbitale degenerieren;; Mit anderen Worten, sie haben die gleiche Energie oder Stabilität (beachten Sie, dass sie ausgerichtet sind)..
Dieser Prozess ist als Hybridisierung bekannt, und dank dessen hat das Kohlenstoffatom jetzt vier sp-Orbitale3 mit jeweils einem Elektron, um vier Bindungen zu bilden. Dies liegt an seiner Eigenschaft, vierwertig zu sein.
sp3
Wenn das Kohlenstoffatom eine sp-Hybridisierung aufweist3, richtet seine vier Hybridorbitale auf die Eckpunkte eines Tetraeders aus, bei dem es sich um seine elektronische Geometrie handelt.
Somit kann man einen Kohlenstoff sp identifizieren3 weil es nur vier einfache Bindungen bildet, wie im Methanmolekül (CH4). Und um ihn herum kann eine tetraedrische Umgebung beobachtet werden.
Die Überlappung von sp-Orbitalen3 es ist so effektiv und stabil, dass die einzelne C-C-Bindung eine Enthalpie von 345,6 kJ / mol aufweist. Dies erklärt, warum es endlose Carbonatstrukturen und eine unermessliche Anzahl organischer Verbindungen gibt. Darüber hinaus können Kohlenstoffatome andere Arten von Bindungen bilden.
spzwei und sp
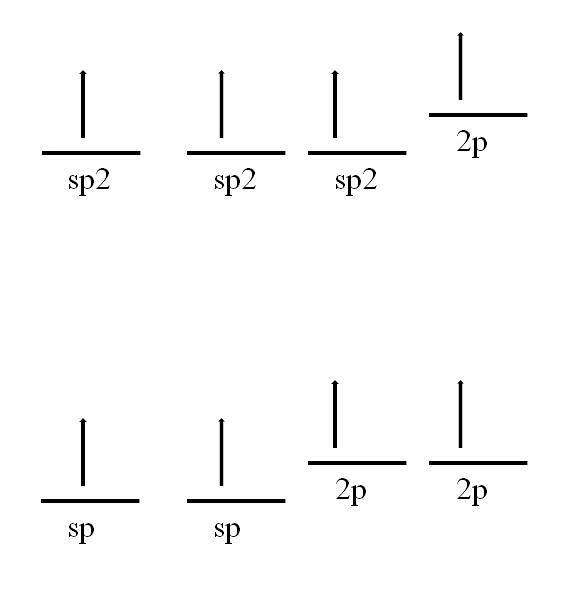
Das Kohlenstoffatom kann auch andere Hybridisierungen annehmen, wodurch es eine Doppel- oder sogar Dreifachbindung eingehen kann.
In sp-Hybridisierungzwei, Wie im Bild zu sehen ist, gibt es drei sp-Orbitalezwei entartet und ein 2p-Orbital bleibt unverändert oder "rein". Mit den drei sp-Orbitalenzwei In einem Abstand von 120º bildet der Kohlenstoff drei kovalente Bindungen, die eine elektronische Geometrie auf trigonaler Ebene zeichnen. während mit dem 2p-Orbital senkrecht zu den anderen drei eine π-Bindung gebildet wird: -C = C.-.
Bei der sp-Hybridisierung sind zwei sp-Orbitale um 180 ° voneinander entfernt, so dass sie eine lineare elektronische Geometrie zeichnen. Diesmal haben sie zwei reine 2p-Orbitale senkrecht zueinander, die es dem Kohlenstoff ermöglichen, Dreifachbindungen oder zwei Doppelbindungen zu bilden: -C≡C- oder ·· C = C = C ·· (der zentrale Kohlenstoff hat sp-Hybridisierung ).
Beachten Sie, dass immer (im Allgemeinen), wenn die Bindungen um den Kohlenstoff hinzugefügt werden, festgestellt wird, dass die Anzahl gleich vier ist. Diese Informationen sind beim Zeichnen von Lewis-Strukturen oder molekularen Strukturen wichtig. Ein Kohlenstoffatom, das fünf Bindungen (= C≡C) bildet, ist theoretisch und experimentell unzulässig.
Einstufung
Wie werden Kohlenstoffatome klassifiziert? Es ist mehr als eine Klassifizierung nach internen Merkmalen, es hängt tatsächlich von der molekularen Umgebung ab. Das heißt, innerhalb eines Moleküls können seine Kohlenstoffatome wie folgt klassifiziert werden.
Primär
Ein Primärkohlenstoff ist einer, der nur an einen anderen Kohlenstoff gebunden ist. Zum Beispiel das Molekül Ethan, CH3-CH3 Es besteht aus zwei gebundenen Primärkohlenstoffen. Dies signalisiert das Ende oder den Beginn einer Kohlenstoffkette.
Sekundär
Es ist eines, das mit zwei Kohlenstoffen verbunden ist. Für das Propanmolekül ist CH3-CHzwei-CH3, Das mittlere Kohlenstoffatom ist sekundär (die Methylengruppe -CHzwei-).
Tertiär
Die tertiären Kohlenstoffe unterscheiden sich vom Rest, weil aus ihnen Zweige der Hauptkette hervorgehen. Zum Beispiel 2-Methylbutan (auch Isopentan genannt), CH3-CH(CH3) -CHzwei-CH3 hat einen fett hervorgehobenen tertiären Kohlenstoff.
Quartär
Und schließlich sind quaternäre Kohlenstoffe, wie der Name schon sagt, mit vier anderen Kohlenstoffatomen verbunden. Das Neopentanmolekül, C.(CH3)4 besitzt ein quaternäres Kohlenstoffatom.
Anwendungen
Atomare Masseneinheit
Die durchschnittliche Atommasse der 12C wird als Standardmaß für die Berechnung der Massen der anderen Elemente verwendet. Somit wiegt Wasserstoff ein Zwölftel dieses Kohlenstoffisotops, mit dem definiert wird, was als bekannt ist Atommasseneinheit u.
Somit können die anderen Atommassen mit denen der verglichen werden 12C und die 1H. Zum Beispiel Magnesium (24Mg) wiegt ungefähr das Doppelte des Gewichts eines Kohlenstoffatoms und das 24-fache eines Wasserstoffatoms.
Kohlenstoffkreislauf und Leben
Pflanzen absorbieren COzwei im Photosyntheseprozess, um Sauerstoff in die Atmosphäre freizusetzen und als pflanzliche Lunge zu wirken. Wenn sie sterben, verwandeln sie sich in Holzkohle, die nach dem Verbrennen wieder CO freisetztzwei. Ein Teil kehrt zu den Pflanzen zurück, ein anderer landet im Meeresboden und nährt viele Mikroorganismen.
Wenn die Mikroorganismen absterben, verbleibt der Feststoff in seinen biologischen Zersetzungssedimenten und wird nach Millionen von Jahren in sogenanntes Öl umgewandelt..
Wenn die Menschheit dieses Öl als alternative Energiequelle zur Verbrennung von Kohle nutzt, trägt es zur Freisetzung von mehr CO beizwei (und andere unerwünschte Gase).
Andererseits verwendet das Leben Kohlenstoffatome aus der Tiefe. Dies ist auf die Stabilität seiner Bindungen zurückzuführen, die es ihm ermöglicht, Ketten und molekulare Strukturen zu bilden, aus denen Makromoleküle bestehen, die genauso wichtig sind wie DNA..
NMR-Spektroskopie 13C.
Das 13C, obwohl es in einem viel kleineren Verhältnis als das der ist 12C, seine Häufigkeit reicht aus, um molekulare Strukturen durch Kohlenstoff-13-Kernspinresonanzspektroskopie aufzuklären.
Dank dieser Analysetechnik ist es möglich zu bestimmen, welche Atome die umgeben 13C und zu welchen funktionellen Gruppen sie gehören. Somit kann das Kohlenstoffgerüst jeder organischen Verbindung bestimmt werden..
Verweise
- Graham Solomons T. W., Craig B. Fryhle. Organische Chemie. Amine. (10. Ausgabe.) Wiley Plus.
- Blake D. (4. Mai 2018). Vier Eigenschaften von Kohlenstoff. Wiederhergestellt von: sciencing.com
- Royal Society of Chemistry. (2018). Kohle. Entnommen aus: rsc.org
- Evolution verstehen. (s.f.). Reise eines Kohlenstoffatoms. Wiederhergestellt von: evolution.berkeley.edu
- Encyclopædia Britannica. (14. März 2018). Kohle. Wiederhergestellt von: britannica.com
- Pappas S. (29. September 2017). Fakten über Kohlenstoff. Wiederhergestellt von: lifescience.com


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.