
Geschichte, Postulate und Beispiele der molekularkinetischen Theorie

Das molekularkinetische Theorie Es ist eines, das versucht, die experimentellen Beobachtungen von Gasen aus einer mikroskopischen Perspektive zu erklären. Das heißt, es wird versucht, die Art und das Verhalten der gasförmigen Partikel mit den physikalischen Eigenschaften des Gases als Flüssigkeit in Verbindung zu bringen. Erklären Sie das Makroskopische vom Mikroskopischen.
Gase waren für Wissenschaftler aufgrund ihrer Eigenschaften schon immer von Interesse. Sie nehmen das gesamte Volumen des Behälters ein, in dem sie sich befinden, und können vollständig komprimiert werden, ohne dass ihr Inhalt dem geringsten Widerstand entgegenwirkt. und wenn die Temperatur steigt, beginnt sich der Behälter auszudehnen und kann sogar reißen.
Viele dieser Eigenschaften und Verhaltensweisen sind in den idealen Gasgesetzen zusammengefasst. Sie betrachten das Gas jedoch als Ganzes und nicht als eine Ansammlung von Millionen von Partikeln, die im Weltraum verstreut sind. Darüber hinaus liefert es auf der Grundlage von Druck-, Volumen- und Temperaturdaten keine weiteren Informationen darüber, wie sich diese Partikel bewegen.
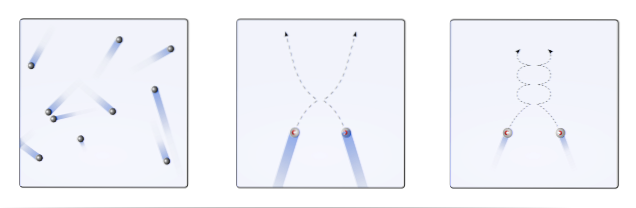
Daher schlägt die molekularkinetische Theorie (TCM) vor, sie als mobile Kugeln zu visualisieren (oberes Bild). Diese Kugeln kollidieren willkürlich miteinander und mit den Wänden und behalten eine lineare Flugbahn bei. Wenn jedoch die Temperatur abnimmt und der Druck zunimmt, wird die Flugbahn der Kugeln gekrümmt..
Ein Gas sollte sich laut TCM wie die Kugeln im ersten Bildrahmen verhalten. Indem sie sich abkühlen und den Druck auf sie erhöhen, ist ihr Verhalten alles andere als ideal. Sie sind dann echte Gase, die kurz vor der Verflüssigung stehen und somit in die flüssige Phase übergehen.
Unter diesen Bedingungen werden die Wechselwirkungen zwischen den Kugeln so wichtig, dass sich ihre Geschwindigkeit vorübergehend verlangsamt. Je näher sie der Verflüssigung kommen, desto kurviger werden ihre Flugbahnen (rechts eingefügt) und desto weniger energisch sind ihre Kollisionen.
Artikelverzeichnis
- 1 Geschichte
- 1.1 Daniel Bernoulli
- 1.2 Rudolf Clausius
- 1.3 James Clerk Maxwell und Ludwig Boltzmann
- 2 Postulate der molekularkinetischen Theorie
- 2.1 Das Volumen der gasförmigen Partikel ist vernachlässigbar
- 2.2 Die Anziehungskräfte zwischen den Partikeln sind Null
- 2.3 Gasförmige Partikel sind immer in Bewegung
- 2.4 Kollisionen zwischen Partikeln und Behälterwänden sind elastisch
- 2.5 Kinetische Energie bleibt nicht konstant
- 2.6 Die durchschnittliche kinetische Energie entspricht für alle Gase einer bestimmten Temperatur
- 3 Beispiele
- 3.1 Boyles Gesetz
- 3.2 Karls Gesetz
- 3.3 Daltons Gesetz
- 4 Referenzen
Geschichte
Daniel Bernoulli
Die Idee dieser Sphären, besser Atome genannt, war bereits vom römischen Philosophen Lucretius in Betracht gezogen worden; Nicht für Gase, sondern für feste, statische Objekte. Andererseits wandte Daniel Bernoulli 1738 das atomare Sehen auf Gase und Flüssigkeiten an, indem er sie sich als ungeordnete Kugeln vorstellte, die sich in alle Richtungen bewegten..
Seine Arbeit verstieß jedoch gegen die damaligen Gesetze der Physik; Ein Körper konnte sich nicht ewig bewegen, daher war es unmöglich zu glauben, dass eine Reihe von Atomen und Molekülen miteinander kollidieren würde, ohne ihre Energie zu verlieren. das Vorhandensein elastischer Kollisionen war nicht möglich.
Rudolf Clausius
Ein Jahrhundert später verstärkten andere Autoren die TCM mit einem Modell, bei dem sich die gasförmigen Partikel nur in eine Richtung bewegten. Rudolf Clausius stellte jedoch seine Ergebnisse zusammen und stellte ein vollständigeres TCM-Modell zusammen, mit dem er die idealen Gasgesetze von Boyle, Charles, Dalton und Avogadro erklären wollte..
James Clerk Maxwell und Ludwig Boltzmann
James Clerk Maxwell erklärte 1859, dass gasförmige Partikel bei einer bestimmten Temperatur einen Geschwindigkeitsbereich aufweisen und dass eine Reihe von Geschwindigkeiten anhand einer durchschnittlichen Molekülgeschwindigkeit berücksichtigt werden kann..
Dann verband Ludwig Boltzmann 1871 bestehende Ideen mit Entropie und wie Gas thermodynamisch immer dazu neigt, homogen und spontan so viel Raum wie möglich einzunehmen.
Postulate der molekularkinetischen Theorie
Um das Gas aus seinen Partikeln zu betrachten, ist ein Modell erforderlich, in dem bestimmte Postulate oder Annahmen erfüllt sind; postuliert, dass logischerweise in der Lage sein muss, makroskopische und experimentelle Beobachtungen (so genau wie möglich) vorherzusagen und zu erklären. Die TCM-Postulate werden jedoch erwähnt und beschrieben.
Das Volumen der gasförmigen Partikel ist vernachlässigbar
In einem mit gasförmigen Partikeln gefüllten Behälter verteilen sich diese und bewegen sich in allen Ecken voneinander weg. Wenn sie für einen Moment alle an einem bestimmten Punkt im Behälter ohne Verflüssigung zusammengebracht werden könnten, würde man beobachten, dass sie nur einen vernachlässigbaren Teil des Volumens des Behälters einnehmen..
Dies bedeutet, dass der Behälter, selbst wenn er Millionen gasförmiger Partikel enthält, tatsächlich mehr leer als voll ist (Volumen-Hohlraum-Verhältnis viel weniger als 1); Wenn seine Barrieren dies zulassen, können es und das darin enthaltene Gas abrupt komprimiert werden. denn am Ende des Tages sind die Partikel sehr klein, ebenso wie ihr Volumen.
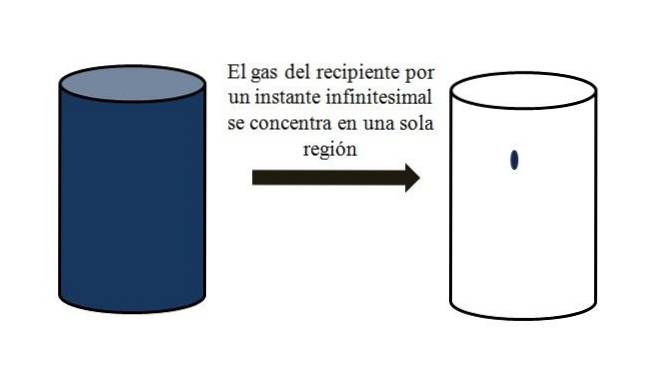
Das obere Bild zeigt das Obige unter Verwendung eines bläulich gefärbten Gases genau.
Die Anziehungskräfte zwischen den Partikeln sind Null
Die gasförmigen Partikel im Behälter kollidieren miteinander, ohne dass genügend Zeit für ihre Wechselwirkungen vorhanden ist, um an Stärke zu gewinnen. noch weniger, wenn sie hauptsächlich von molekularem Vakuum umgeben sind. Eine unmittelbare Folge davon ist, dass ihre linearen Pfade es ihnen ermöglichen, das Volumen des Behälters vollständig zu erfassen..
Wenn dies nicht der Fall wäre, hätte ein Behälter mit einer "bizarren" und "labyrinthischen" Form infolge der Gaskondensation feuchte Bereiche; Stattdessen bewegen sich die Partikel mit voller Freiheit um den Behälter, ohne dass die Kraft ihrer Wechselwirkungen sie aufhält.
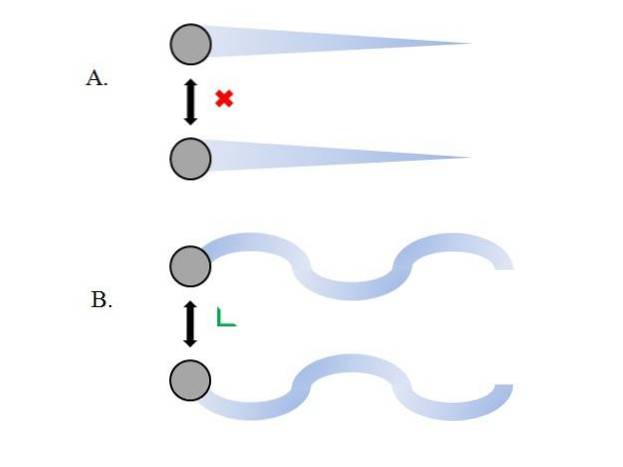
Die linearen Trajektorien des oberen Bildes (A.) zeigen dieses Postulat; Wenn die Trajektorien gekrümmt sind (B.), zeigt dies, dass es Wechselwirkungen gibt, die zwischen den Partikeln nicht ignoriert werden können.
Gasförmige Partikel sind immer in Bewegung
Aus den ersten beiden Postulaten geht auch hervor, dass die Gaspartikel niemals aufhören, sich zu bewegen. Sobald sie im Behälter verschwommen sind, kollidieren sie miteinander und mit seinen Wänden mit einer Kraft und Geschwindigkeit, die direkt proportional zur absoluten Temperatur ist. Diese Kraft ist Druck.
Wenn sich die gasförmigen Partikel für einen Moment nicht mehr bewegen würden, würden "Rauchzungen" im Inneren des Behälters beobachtet, die aus dem Nichts auftauchen und genügend Zeit haben, sich in einem Vakuum anzuordnen und zufällige Formen zu geben..
Kollisionen zwischen den Partikeln und den Wänden des Behälters sind elastisch
Wenn im Inneren des Behälters nur elastische Kollisionen zwischen den gasförmigen Partikeln und den Wänden des Behälters überwiegen, tritt niemals eine Kondensation des Gases auf (solange sich die physikalischen Bedingungen nicht ändern). oder was ist das gleiche wie zu sagen, dass sie sich nie ausruhen und immer kollidieren.
Dies liegt daran, dass bei elastischen Kollisionen kein Nettoverlust an kinetischer Energie auftritt. Ein Teilchen kollidiert mit der Wand und springt mit der gleichen Geschwindigkeit. Wenn ein Teilchen beim Zusammenstoß langsamer wird, beschleunigt das andere, ohne Wärme oder Schall zu erzeugen, die die kinetische Energie eines der beiden abführen.
Die kinetische Energie bleibt nicht konstant
Die Bewegung der Teilchen ist zufällig und chaotisch, so dass sie nicht alle die gleiche Geschwindigkeit haben; so wie es zum Beispiel auf einer Autobahn oder in einer Menschenmenge passiert. Einige sind energischer und reisen schneller, während andere langsam sind und auf eine Kollision warten, um sie zu beschleunigen.
Um seine Geschwindigkeit zu beschreiben, muss dann ein Durchschnitt berechnet werden. und damit wird wiederum die durchschnittliche kinetische Energie der gasförmigen Teilchen oder Moleküle erhalten. Da sich die kinetische Energie aller Partikel ständig ändert, ermöglicht der Durchschnitt eine bessere Kontrolle der Daten und kann mit größerer Zuverlässigkeit bearbeitet werden..
Die durchschnittliche kinetische Energie entspricht für alle Gase einer bestimmten Temperatur
Durchschnittliche molekulare kinetische Energie (ECmp) in einem Behälter ändert sich mit der Temperatur. Je höher die Temperatur, desto höher ist die Energie. Da es sich um einen Durchschnitt handelt, kann es Partikel oder Gase geben, die eine höhere oder niedrigere Energie als diesen Wert haben. einige schneller bzw. einige langsamer.
Mathematisch kann gezeigt werden, dass ECmp es hängt ausschließlich von der Temperatur ab. Dies bedeutet, dass unabhängig von der Größe des Gases, seiner Masse oder Molekülstruktur seine ECmp es ist bei einer Temperatur T gleich und variiert nur, wenn es zunimmt oder abnimmt. Von allen Postulaten ist dies vielleicht das relevanteste..
Und was ist mit der durchschnittlichen molekularen Geschwindigkeit? Im Gegensatz zu ECmp, Molekularmasse beeinflusst die Geschwindigkeit. Je schwerer das gasförmige Teilchen oder Molekül ist, desto natürlicher ist zu erwarten, dass es sich langsamer bewegt..
Beispiele
Hier einige kurze Beispiele, wie es der TCM gelungen ist, die idealen Gasgesetze zu erklären. Obwohl nicht angesprochen, können mit TCM auch andere Phänomene wie Gasdiffusion und -erguss erklärt werden.
Boyles Gesetz
Wenn das Volumen des Behälters bei konstanter Temperatur komprimiert wird, verringert sich die Entfernung, die die gasförmigen Partikel zurücklegen müssen, um mit den Wänden zu kollidieren. Dies entspricht einer Zunahme der Häufigkeit solcher Kollisionen, was zu einem höheren Druck führt. Da die Temperatur konstant bleibt, wird ECmp es ist auch konstant.
Charles Law
Wenn Sie T erhöhen, ECmp wird steigen. Die gasförmigen Partikel bewegen sich schneller und kollidieren häufiger mit den Wänden des Behälters. so steigt der Druck.
Wenn die Wände flexibel sind und sich ausdehnen können, wird ihre Fläche größer und der Druck fällt ab, bis er konstant wird. Infolgedessen erhöht sich auch die Lautstärke.
Daltons Gesetz
Wenn einem geräumigen Behälter, der aus kleineren Behältern stammt, mehrere Liter verschiedener Gase zugesetzt würden, wäre sein Gesamtinnendruck gleich der Summe der Partialdrücke, die von jeder Art von Gas separat ausgeübt werden..
Warum? Weil alle Gase miteinander kollidieren und sich homogen verteilen; Die Wechselwirkungen zwischen ihnen sind null, und das Vakuum überwiegt im Behälter (TCM-Postulate). Es ist also so, als ob jedes Gas allein wäre und seinen Druck einzeln ausübt, ohne dass die anderen Gase eingreifen.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). CENGAGE Learning, S. 426-431.
- Fernandez Pablo. (2019). Molekulare kinetische Theorie. Vix. Wiederhergestellt von: vix.com
- Jones, Andrew Zimmerman. (7. Februar 2019). Kinetische Molekulartheorie von Gasen. Wiederhergestellt von :oughtco.com
- Halle Nancy. (5. Mai 2015). Kinetische Theorie der Gase. Glenn Research Center. Wiederhergestellt von: grc.nasa.gov
- Blaber M. & Lower S. (9. Oktober 2018). Grundlagen der kinetischen Molekulartheorie. Chemie LibreTexts. Wiederhergestellt von: chem.libretexts.org
- Die kinetische Molekulartheorie. Wiederhergestellt von: chemed.chem.purdue.edu
- Wikipedia. (2019). Kinetische Theorie der Gase. Wiederhergestellt von: en.wikipedia.org
- Toppr. (s.f.). Kinetische Molekulartheorie von Gasen. Wiederhergestellt von: toppr.com


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.