
Kupfersulfidstruktur, Eigenschaften, Verwendungen

Das Kupfersulfid ist eine Familie anorganischer Verbindungen, deren allgemeine chemische Formel Cu istxS.Y.. Ja x Es ist größer als Y. es bedeutet, dass das Sulfid kupferreicher ist als Schwefel; und wenn im Gegenteil, x Es ist kleiner als Y., dann ist Schwefel schwefelreicher als Kupfer.
In der Natur überwiegen zahlreiche Mineralien, die natürliche Quellen dieser Verbindung darstellen. Fast alle von ihnen sind kupferreicher als Schwefel, und ihre Zusammensetzung wird durch die Formel Cu ausgedrückt und vereinfachtxS; Hier x kann sogar Bruchwerte annehmen, was auf einen nichtstöchiometrischen Feststoff (Cu) hinweist1,75S zum Beispiel).

Obwohl Schwefel in seinem elementaren Zustand gelb ist, erscheinen seine abgeleiteten Verbindungen von dunkler Farbe; Dies ist auch bei Kupfersulfid der Fall. Das Mineral Covelit (oberes Bild), das hauptsächlich aus CuS besteht, zeigt jedoch metallischen Glanz und bläuliches Schillern..
Sie können aus verschiedenen Kupfer- und Schwefelquellen unter Verwendung verschiedener Techniken und Variation der Syntheseparameter hergestellt werden. So können Sie CuS-Nanopartikel mit interessanten Morphologien erhalten.
Artikelverzeichnis
- 1 Struktur von Kupfersulfid
- 1.1 Links
- 1.2 Koordinationen in der Covelita
- 1.3 Andere Kristalle
- 2 Eigenschaften
- 2.1 Allgemeines
- 2.2 Covelit
- 3 Verwendungen
- 3.1 Nanopartikel in der Medizin
- 3.2 Nanowissenschaften
- 4 Referenzen
Struktur von Kupfersulfid
Links
Diese Verbindung scheint kristallin zu sein, so dass sofort angenommen werden kann, dass sie aus Cu-Ionen besteht+ (einwertiges Kupfer), Cuzwei+ (zweiwertiges Kupfer), S.zwei- und einschließlich S.zwei- und S.zweizwei- (Disulfidanionen), die durch elektrostatische Kräfte oder Ionenbindung interagieren.
Es gibt jedoch einen leichten kovalenten Charakter zwischen Cu und S, und daher kann die Cu-S-Bindung nicht ausgeschlossen werden. Aus dieser Überlegung heraus beginnt sich die Kristallstruktur von CuS (und die aller abgeleiteten Feststoffe) von denen zu unterscheiden, die für andere ionische oder kovalente Verbindungen gefunden oder charakterisiert wurden..
Mit anderen Worten, wir können nicht von reinen Ionen sprechen, aber in der Mitte ihrer Anziehungskräfte (Kation-Anion) gibt es eine leichte Überlappung ihrer äußeren Orbitale (Elektronenteilung)..
Koordinationen in la covelita
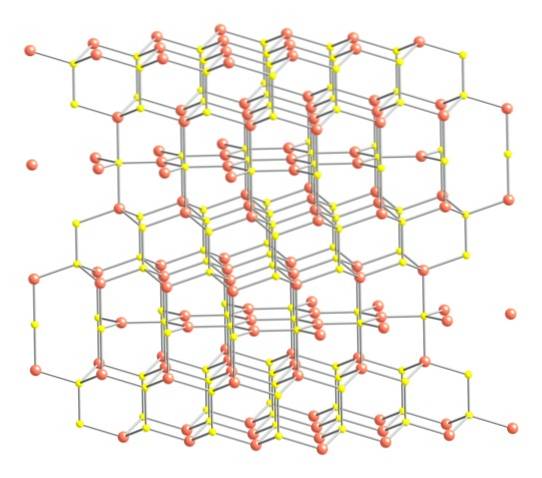
Nachdem dies gesagt wurde, ist die Kristallstruktur des Covelits im oberen Bild gezeigt. Es besteht aus hexagonalen Kristallen (definiert durch die Parameter ihrer Einheitszellen), in denen sich die Ionen vereinigen und in unterschiedlichen Koordinationen orientieren. Dies sind mit einer unterschiedlichen Anzahl von nahen Nachbarn.
Im Bild werden Kupferionen durch rosa Kugeln dargestellt, während Schwefelionen durch gelbe Kugeln dargestellt werden..
Wenn man die Aufmerksamkeit zuerst auf die rosa Kugeln richtet, wird man bemerken, dass einige von drei gelben Kugeln umgeben sind (Koordination der trigonalen Ebene) und andere von vier (tetraedrische Koordination)..
Die erste Art von Kupfer, trigonal, kann in den Ebenen senkrecht zu den dem Leser zugewandten hexagonalen Flächen identifiziert werden, in denen wiederum die zweite Art von Kohlenstoff, tetraedrisch, dargestellt ist.
Wenden wir uns nun den gelben Kugeln zu: Einige haben fünf rosa Kugeln als Nachbarn (trigonale Bipyramiden-Koordination), andere drei und eine gelbe Kugel (wiederum tetraedrische Koordination). In letzterem ist das Disulfidanion zu sehen, das unterhalb und innerhalb derselben Struktur des Covelits zu sehen ist:
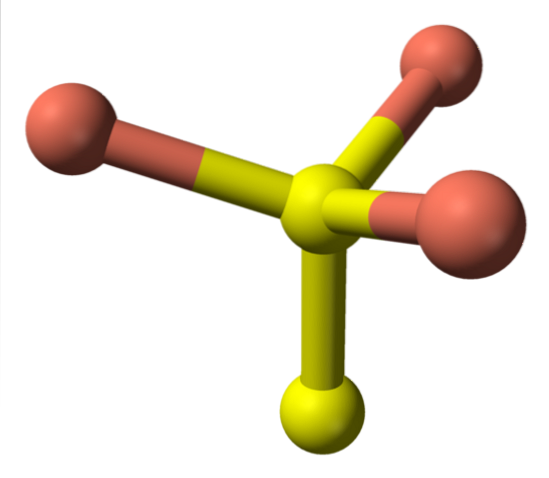
Alternative Formel
Es gibt dann Cu-Ionenzwei+, Cu+, S.zwei- und S.zweizwei-. Studien, die mit Röntgenphotoelektronenspektroskopie (XPS) durchgeführt wurden, zeigen jedoch, dass alles Kupfer als Cu-Kationen vorliegt+;; und daher wird die Anfangsformel CuS "besser" ausgedrückt als (Cu+)3(S.2−) (S.zwei)- -.
Es ist zu beachten, dass das Cu: S-Verhältnis für die obige Formel weiterhin 1 ist und sich außerdem die Ladungen aufheben.
Andere Kristalle
Ein Kupfersulfid kann orthorhombische Kristalle annehmen, wie im polymorphen γ-CuzweiS aus Chalkocit; kubisch, wie in einem anderen Polymorph von Chalkocit, α-CuzweiS; tetragonal, im Mineral Anilit, Cu1,75S; Monoklinik, in der Djurleita, Cu1,96Ja unter anderem.
Für jeden definierten Kristall gibt es ein Mineral, und jedes Mineral hat wiederum seine eigenen Eigenschaften und Eigenschaften.
Eigenschaften
Allgemeines
Die Eigenschaften von Kupfersulfid hängen vom Cu: S-Verhältnis seiner Feststoffe ab. Zum Beispiel solche mit S-Anionenzweizwei- haben hexagonale Strukturen und können entweder Halbleiter oder metallische Leiter sein.
Wenn andererseits der Schwefelgehalt nur aus Anionen S bestehtzwei-, Sulfide verhalten sich wie Halbleiter und weisen auch bei hohen Temperaturen Ionenleitfähigkeiten auf. Dies liegt daran, dass seine Ionen zu schwingen beginnen und sich in den Kristallen bewegen, wodurch elektrische Ladungen transportiert werden..
Optisch können Sulfide, obwohl dies auch von ihrer Kupfer- und Schwefelzusammensetzung abhängt, Strahlung im Infrarotbereich des elektromagnetischen Spektrums absorbieren oder nicht. Diese optischen und elektrischen Eigenschaften machen es zu potenziellen Materialien, die in verschiedenen Gerätebereichen implementiert werden können..
Eine weitere zu berücksichtigende Variable ist neben dem Cu: S-Verhältnis die Größe der Kristalle. Es gibt nicht nur mehr "Schwefel" - oder "Kupfer" -Kupfersulfide, sondern die Abmessungen ihrer Kristalle wirken sich auch ungenau auf ihre Eigenschaften aus. Daher sind Wissenschaftler bestrebt, Cu-Nanopartikel zu untersuchen und nach Anwendungen zu suchen.xS.Y..
Covelite
Jedes Mineral oder Kupfersulfid hat einzigartige Eigenschaften. Von allen ist Covelit jedoch aus struktureller und ästhetischer Sicht am interessantesten (aufgrund seines Schillerns und seiner Blautöne). Daher werden einige seiner Eigenschaften unten erwähnt.
Molmasse
95,611 g / mol.
Dichte
4,76 g / ml.
Schmelzpunkt
500 ° C; aber es bricht zusammen.
Wasserlöslichkeit
3.3 10-5 g / 100 ml bei 18 ° C..
Anwendungen
Nanopartikel in der Medizin
Die Größe der Partikel variiert nicht nur, bis sie nanometrische Dimensionen erreichen, sondern ihre Morphologien können auch stark variieren. So kann Kupfersulfid Nanokugeln, Stäbe, Platten, Dünnfilme, Käfige, Kabel oder Röhren bilden..
Diese Partikel und ihre attraktiven Morphologien finden individuelle Anwendung in verschiedenen Bereichen der Medizin..
Beispielsweise können Nanokäfige oder leere Kugeln als Wirkstoffträger im Körper dienen. Nanokugeln wurden verwendet, unterstützt von Kohlenstoffglaselektroden und Kohlenstoffnanoröhren, um als Glucosedetektoren zu fungieren; sowie seine Aggregate reagieren empfindlich auf den Nachweis von Biomolekülen wie DNA.
CuS-Nanoröhren übertreffen Nanokugeln beim Nachweis von Glukose. Zusätzlich zu diesen Biomolekülen wurden Immunosensoren aus dünnen CuS-Filmen und bestimmten Trägern zum Nachweis von Krankheitserregern entwickelt..
Nanokristalle und amorphe Aggregate von CuS können sogar die Apoptose von Krebszellen verursachen, ohne gesunde Zellen zu schädigen.
Nanowissenschaften
Im vorherigen Unterabschnitt wurde gesagt, dass seine Nanopartikel Teil von Biosensoren und Elektroden waren. Zusätzlich zu solchen Anwendungen haben Wissenschaftler und Techniker ihre Eigenschaften genutzt, um Solarzellen, Kondensatoren, Lithiumbatterien und Katalysatoren für sehr spezifische organische Reaktionen zu entwickeln. Unverzichtbare Elemente in den Nanowissenschaften.
Erwähnenswert ist auch, dass sich das NpCuS-CA-Set (CA: Activated Carbon und Np: Nanoparticles) bei Unterstützung auf Aktivkohle als Entferner für für den Menschen schädliche Farbstoffe erwies und daher als Reinigungsmittel für Quellen von Wasser absorbiert unerwünschte Moleküle.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2019). Kupfersulfid. Wiederhergestellt von: en.wikipedia.org
- Ivan Grozdanov und Metodija Najdoski. (1995). Optische und elektrische Eigenschaften von Kupfersulfidfilmen variabler Zusammensetzung. Journal of Solid State Chemistry, Band 114, Ausgabe 2, 1. Februar 1995, Seiten 469-475. doi.org/10.1006/jssc.1995.1070
- Nationales Zentrum für Informationen zur Biotechnologie. (2019). Kupfersulfid (CuS). PubChem-Datenbank. CID = 14831. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Peter A. Ajibade und Nandipha L. Botha. (2017). Synthese, optische und strukturelle Eigenschaften
- von Kupfersulfid-Nanokristallen aus Einzelmolekül-Vorläufern. Institut für Chemie, Universität Fort Hare, Private Bag X1314, Alice 5700, Südafrika. Nanomaterialien, 7, 32.
- Zusammenarbeit: Autoren und Herausgeber der Bände III / 17E-17F-41C (s.f.). Kupfersulfide (Cu2S, Cu (2-x) S) -Kristallstruktur, Gitterparameter. In: Madelung O., Rössler U., Schulz M. (Hrsg.) Nicht-tetraedrisch gebundene Elemente und binäre Verbindungen I. Kondensierte Materie der Landolt-Börnstein-Gruppe III (Numerische Daten und funktionale Beziehungen in Wissenschaft und Technologie), Band 41C. Springer, Berlin, Heidelberg.
- F. Momtazan, A. Vafaei, M. Ghaedi et al. Korean J. Chem. Eng. (2018). Anwendung von mit Kupfersulfid-Nanopartikeln beladener Aktivkohle zur gleichzeitigen Adsorption von ternären Farbstoffen: Reaktionsoberflächenmethode. 35: 1108. doi.org/10.1007/s11814-018-0012-1
- Goel, S., Chen, F. & Cai, W. (2014). Synthese und biomedizinische Anwendungen von Kupfersulfid-Nanopartikeln: von Sensoren bis zur Theranostik. Klein (Weinheim an der Bergstraße, Deutschland), 10 (4), 631-645. doi: 10.1002 / smll.201301174



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.