
Progressives Sublimationskonzept, -prozess und -beispiele

Das progressive Sublimation Es ist ein thermodynamischer Prozess, bei dem eine endotherme Zustandsänderung direkt von einem Feststoff zu einem Gas ohne vorherige Bildung der Flüssigkeit auftritt. Das Verhalten des Feststoffs unter normalen Bedingungen besteht darin, sich zu erwärmen und zu schmelzen; das heißt, zu verschmelzen. Währenddessen beginnt der Feststoff bei der Sublimation direkt zu rauchen, ohne dass zuvor Tropfen auftreten, die auf sein Schmelzen hinweisen..
Was im obigen Absatz beschrieben ist, ist im obigen Bild dargestellt. Angenommen, eine feste Orangenmischung (links), die sich zu erwärmen beginnt. Die Mischung besteht aus zwei Komponenten oder Feststoffen: einer gelben und einer roten, deren Kombination die orange Farbe ergibt..
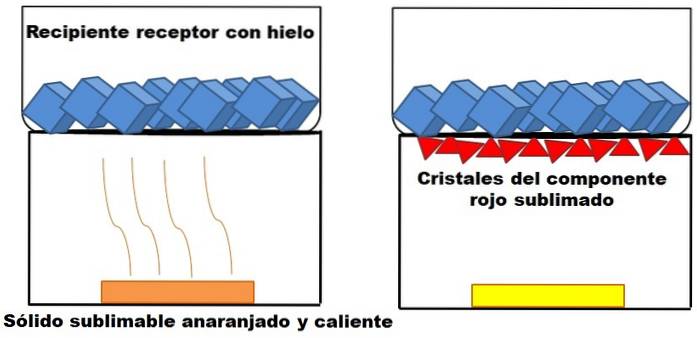
Der rote Feststoff sublimiert, da sich daraus keine Flüssigkeit bildet, sondern sich am Boden des oberen Behälters ablagert (rote Dreiecke); derjenige, der Eiswürfel enthält und daher eine kalte Oberfläche bietet. Währenddessen bleibt der gelbe Feststoff durch Hitze unverändert (gelbes Rechteck).
Die roten Dreiecke oder Kristalle setzen sich dank der kalten Oberfläche des Aufnahmebehälters (rechts) ab, die ihre Temperatur absorbiert. Und selbst wenn es nicht angezeigt wird, sollte die Größe Ihrer Eiswürfel aufgrund der Wärmeaufnahme abnehmen. Der gelbe Feststoff ist nicht sublimierbar, und wenn Sie ihn früher oder später weiter erhitzen, schmilzt er.
Artikelverzeichnis
- 1 Progressives Sublimationskonzept
- 1.1 Prozess
- 1.2 Von der festen Struktur zur gasförmigen Störung
- 1.3 Phasendiagramm und Tripelpunkt
- 1.4 Bedingungen
- 2 Beispiele
- 2.1 Reinigung von Feststoffen
- 2.2 Kristallsynthese
- 3 Referenzen
Progressives Sublimationskonzept
Prozess
Es wurde bereits gesagt, dass Sublimation eine endotherme Zustandsänderung ist, denn damit sie auftritt, muss es eine Wärmeabsorption geben. Wenn der Feststoff Wärme absorbiert, nimmt seine Energie zu, sodass seine Partikel auch bei höheren Frequenzen schwingen..
Wenn diese Schwingungen sehr stark werden, beeinflussen sie intermolekulare Wechselwirkungen (keine kovalenten Bindungen). und folglich nehmen die Teilchen früher oder später mehr Abstände voneinander ein, bis sie es schaffen, sich freier durch die Regionen des Weltraums zu bewegen und zu bewegen.
In einigen Festkörpern sind die Schwingungen so stark, dass einige Partikel aus der Struktur "herausschießen", anstatt in sich bewegenden Clustern zu agglomerieren, die ein Tröpfchen definieren. Diese Partikel entweichen und bilden die erste "Blase", die eher die ersten Dämpfe des sublimierten Feststoffs bilden würde..
Wir sprechen dann nicht von einem Schmelzpunkt, sondern von einem Sublimationspunkt. Obwohl beide vom Druck abhängen, der auf den Feststoff herrscht, ist der Sublimationspunkt stärker; Daher ändert sich seine Temperatur erheblich mit Druckänderungen (ebenso wie der Siedepunkt)..
Von der festen Struktur zur gasförmigen Störung
Bei der Sublimation wird auch gesagt, dass die Entropie des Systems zunimmt. Die Energiezustände der Teilchen gehen von der Begrenzung durch ihre festen Positionen in der festen Struktur bis zur Homogenisierung in ihren kapriziösen und chaotischen Richtungen im gasförmigen Zustand, gleichmäßiger, wo sie schließlich eine durchschnittliche kinetische Energie erhalten..
Phasendiagramm und Tripelpunkt
Der Sublimationspunkt hängt vom Druck ab; denn sonst würden die festen Teilchen Wärme absorbieren, um nicht in den Raum außerhalb des Feststoffs zu schießen, sondern um Tröpfchen zu bilden. Es würde nicht sublimieren, aber es würde schmelzen oder schmelzen, wie es am üblichsten ist.
Je höher der Außendruck ist, desto weniger wahrscheinlich ist eine Sublimation, da der Feststoff zum Schmelzen gezwungen wird.
Aber welche Feststoffe sind sublimierbar und welche nicht? Die Antwort liegt in Ihren P vs T-Phasendiagrammen, wie das unten gezeigte:
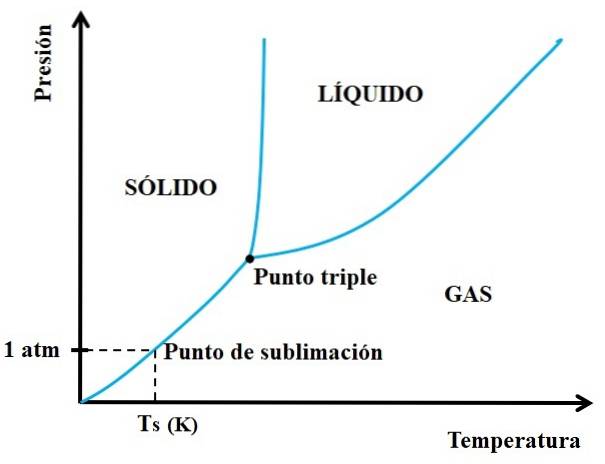
Wir müssen zuerst den Tripelpunkt betrachten und durch den unteren Abschnitt gehen: den, der den festen und den gasförmigen Zustand trennt. Beachten Sie, dass im Bereich des Feststoffs ein Druckabfall auftreten muss, damit eine Sublimation auftritt (nicht unbedingt bei 1 atm, unserem atmosphärischen Druck). Bei 1 atm sublimiert die hypothetische Substanz bei einer Temperatur Ts, ausgedrückt in K..
Je länger und horizontaler der Abschnitt oder die Kurve unterhalb des Tripelpunkts ist, desto größer ist die Fähigkeit des Feststoffs, bei verschiedenen Temperaturen zu sublimieren. Wenn es jedoch deutlich unter 1 atm liegt, sind hohe Vakuums erforderlich, um eine Sublimation zu erreichen, so dass die Drücke gesenkt werden (z. B. 0,0001 atm)..
Bedingungen
Wenn der Tripelpunkt tausendfach niedriger als der atmosphärische Druck ist, wird der Feststoff selbst bei Anwendung von Ultravakuum niemals sublimieren (ganz zu schweigen von seiner Zersetzungsanfälligkeit durch Wärmeeinwirkung)..
Ist dies nicht der Fall, werden die Sublimationen durchgeführt, indem mäßig erhitzt und der Feststoff einem Vakuum ausgesetzt wird, damit seine Partikel leichter entweichen können, ohne dass sie so viel Wärme absorbieren müssen..
Die Sublimation wird besonders wichtig, wenn es sich um Feststoffe mit hohem Dampfdruck handelt. das heißt, der Druck im Inneren spiegelt die Effizienz ihrer Wechselwirkungen wider. Je höher der Dampfdruck ist, desto duftender ist er und desto sublimierbarer ist er..
Beispiele
Feststoffreinigung
Das Bild des orangefarbenen Feststoffs und seiner sublimierbaren rötlichen Komponente ist ein Beispiel dafür, was Sublimation in Bezug auf die Reinigung von Feststoffen darstellt. Rote Dreiecke können nach Bedarf erneut sublimiert werden, bis eine hohe Reinheit gewährleistet ist.
Diese Technik wird hauptsächlich bei duftenden Feststoffen angewendet. Zum Beispiel: Kampfer, Koffein, Benzoe und Menthol.
Unter anderen Feststoffen, die Sublimation sein können, haben wir: Jod, Eis (in großen Höhen), Theobromin (aus Schokolade), Saccharin, Morphin und andere Arzneimittel, stickstoffhaltige Basen und Anthracen.
Kristallsynthese
Zurück zu den roten Dreiecken bietet die Sublimation eine Alternative zur herkömmlichen Kristallisation. Kristalle werden nicht mehr aus einer Lösung synthetisiert, sondern durch möglichst kontrollierte Ablagerung von Dämpfen auf einer kalten Oberfläche, wo es zweckmäßigerweise kristalline Keime geben kann, um eine bestimmte Morphologie zu begünstigen.
Wenn Sie rote Quadrate haben, behält das Kristallwachstum diese Geometrie bei und sie sollten nicht dreieckig werden. Die roten Quadrate wachsen allmählich, wenn die Sublimation stattfindet. Es ist jedoch ein operativ und molekular komplexer Komplex, an dem viele Variablen beteiligt sind..
Beispiele für durch Sublimation synthetisierte Kristalle sind: Siliciumcarbid (SiC), Graphit, Arsen, Selen, Phosphor, Aluminiumnitrid (AlN), Cadmiumsulfid (CdS), Zinkselenid (ZnSe), Quecksilberiodid (HgI).zwei), unter anderem Graphen.
Beachten Sie, dass dies tatsächlich zwei miteinander verflochtene Phänomene sind: progressive Sublimation und Ablagerung (oder inverse Sublimation); Der Dampf wandert vom Feststoff in kältere Regionen oder Oberflächen und setzt sich schließlich in Form von Kristallen ab.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). CENGAGE Lernen.
- Wikipedia. (2019). Sublimation (Phasenübergang). Wiederhergestellt von: en.wikipedia.org
- Jones, Andrew Zimmerman. (27. Januar 2019). Sublimation. Wiederhergestellt von :oughtco.com
- Sheila Morrissey. (2019). Was ist Sublimation in der Chemie? - Definition, Prozess & Beispiele. Studie. Wiederhergestellt von: study.com
- Elsevier B.V. (2019). Sublimationsmethode. ScienceDirect. Wiederhergestellt von: sciencedirect.com



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.