
Eigenschaften, Herstellung, Beispiele der Pufferlösungen

Das Pufferlösungen oder Puffer sind solche, die pH-Änderungen aufgrund von H-Ionen verringern können3ODER+ und OH-. In Abwesenheit dieser Systeme sind einige Systeme (z. B. physiologische) geschädigt, da ihre Komponenten sehr empfindlich auf plötzliche Änderungen des pH-Werts reagieren.
So wie Stoßdämpfer in Autos den durch ihre Bewegung verursachten Aufprall verringern, tun Puffer dasselbe, jedoch mit der Säure oder Basizität der Lösung. Darüber hinaus legen Puffer einen bestimmten pH-Bereich fest, innerhalb dessen sie effizient sind..

Ansonsten sind die H-Ionen3ODER+ Sie säuern die Lösung an (der pH-Wert fällt auf Werte unter 6), was zu einer möglichen Änderung der Reaktionsausbeute führt. Das gleiche Beispiel kann für basische pH-Werte angewendet werden, dh größer als 7.
Artikelverzeichnis
- 1 Funktionen
- 1.1 Zusammensetzung
- 1.2 Sie neutralisieren sowohl Säuren als auch Basen
- 1.3 Effizienz
- 2 Vorbereitung
- 3 Beispiele
- 4 Referenzen
Eigenschaften
Komposition
Sie bestehen im wesentlichen aus einer Säure (HA) oder einer schwachen Base (B) und Salzen ihrer konjugierten Base oder Säure. Folglich gibt es zwei Arten: Säurepuffer und alkalische Puffer..
Säurepuffer entsprechen dem HA / A-Paar-, wohin- ist die konjugierte Base der schwachen Säure HA und interagiert mit Ionen - wie Na+- Natriumsalze zu bilden. Auf diese Weise bleibt das Paar als HA / NaA erhalten, obwohl es auch Kalium- oder Calciumsalze sein kann.
Abgeleitet von der schwachen Säure HA puffert es saure pH-Bereiche (weniger als 7) gemäß der folgenden Gleichung:
HA + OH- => A.- + H.zweiODER
Da es sich jedoch um eine schwache Säure handelt, wird ihre konjugierte Base teilweise hydrolysiert, um einen Teil des verbrauchten HA zu regenerieren:
ZU- + H.zweiODER <=> HA + OH-
Andererseits bestehen alkalische Puffer aus dem B / HB-Paar+, wo HB+ es ist die konjugierte Säure der schwachen Base. Im Allgemeinen ist HB+ bildet mit Chloridionen Salze und hinterlässt das Paar als B / HBCl. Diese Puffer puffern basische pH-Bereiche (größer als 7):
B + H.3ODER+ => HB+ + H.zweiODER
Und wieder HB+ kann teilweise hydrolysiert werden, um einen Teil des verbrauchten B zu regenerieren:
HB+ + H.zweiODER <=> B + H.3ODER+
Sie neutralisieren sowohl Säuren als auch Basen
Während saure Puffer den sauren pH-Wert und den basischen pH-Wert der alkalischen Puffer puffern, können beide mit H-Ionen reagieren.3ODER+ und OH- durch diese Reihe chemischer Gleichungen:
ZU- + H.3ODER+ => HA + H.zweiODER
HB+ + Oh- => B + H.zweiODER
Somit ist im Fall des HA / A-Paares-, HA reagiert mit OH-Ionen-, während ein- -seine konjugierte Base reagiert mit dem H.3ODER+. In Bezug auf das B / HB-Paar+, B reagiert mit H-Ionen3ODER+, während HB+ -seine konjugierte Säure- mit dem OH-.
Dadurch können beide Puffer sowohl saure als auch basische Spezies neutralisieren. Das Ergebnis des Obigen gegenüber beispielsweise der konstanten Zugabe von Mol OH-, ist die Abnahme der pH-Variation (ΔpH):
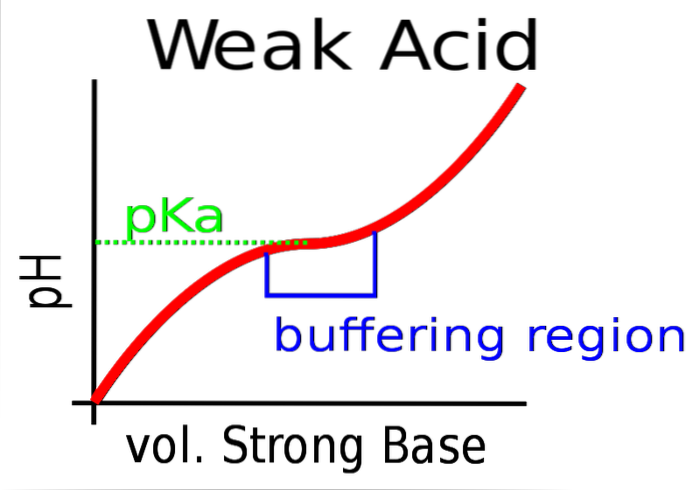
Das obere Bild zeigt die Pufferung des pH-Werts gegen eine starke Base (Donor von OH)-).
Anfangs ist der pH-Wert aufgrund der Anwesenheit von HA sauer. Wenn die starke Base hinzugefügt wird, werden die ersten Mol A gebildet- und der Puffer beginnt zu wirken.
Es gibt jedoch einen Bereich der Kurve, in dem die Steigung weniger steil ist. das heißt, wo die Dämpfung effizienter ist (bläuliche Box).
Effizienz
Es gibt verschiedene Möglichkeiten, das Konzept der Dämpfungseffizienz zu verstehen. Eine davon besteht darin, die zweite Ableitung des Kurven-pH gegen das Volumen der Base zu bestimmen und nach V für den Minimalwert zu lösen, der Veq / 2 ist.
Veq ist das Volumen am Äquivalenzpunkt; Dies ist das Volumen der Base, das benötigt wird, um die gesamte Säure zu neutralisieren.
Ein anderer Weg, es zu verstehen, ist durch die berühmte Henderson-Hasselbalch-Gleichung:
pH = pKzu + log ([B] / [A])
Hier bezeichnet B die Base, A die Säure und pKzu ist der kleinste Logarithmus der Säurekonstante. Diese Gleichung gilt sowohl für die Säurespezies HA als auch für die konjugierte Säure HB+.
Wenn [A] in Bezug auf [B] sehr groß ist, nimmt log () einen sehr negativen Wert an, der vom pK subtrahiert wirdzu. Wenn andererseits [A] in Bezug auf [B] sehr klein ist, nimmt der Wert von log () einen sehr positiven Wert an, der zu pK addiert wirdzu. Wenn jedoch [A] = [B] ist, ist log () 0 und der pH = pKzu.
Was bedeutet das alles? Dass das ΔpH in den für die Gleichung berücksichtigten Extremen größer ist, während es bei einem pH gleich dem pK minimal istzu;; und wie der pKzu ist charakteristisch für jede Säure, dieser Wert bestimmt den pK-Bereichzu± 1.
Die pH-Werte innerhalb dieses Bereichs sind diejenigen, bei denen der Puffer am effizientesten ist..
Vorbereitung
Um eine Pufferlösung herzustellen, müssen Sie die folgenden Schritte beachten:
- Kennen Sie den erforderlichen pH-Wert und daher den, den Sie während der Reaktion oder des Prozesses so konstant wie möglich halten möchten.
- Wenn man den pH-Wert kennt, sucht man nach allen schwachen Säuren, denen, deren pKzu ist näher an diesem Wert.
- Nach Auswahl der HA-Spezies und Berechnung der Konzentration des Puffers (abhängig davon, wie viel Base oder Säure neutralisiert werden muss) wird die erforderliche Menge seines Natriumsalzes gewogen..
Beispiele
Essigsäure hat einen pKzu von 4,75, CH3COOH; daher eine Mischung aus bestimmten Mengen dieser Säure und Natriumacetat, CH3COONa bilden einen Puffer, der im pH-Bereich (3,75-5,75) effizient puffert..
Andere Beispiele für monoprotische Säuren sind Benzoesäuren (C.6H.5COOH) und Ameisensäure (HCOOH). Für jeden von diesen ihre pK-Wertezu sie sind 4,18 und 3,68; Daher sind ihre höchsten Puffer-pH-Bereiche (3,18-5,18) und (2,68-4,68)..
Andererseits können polyprotische Säuren wie Phosphorsäure (H.3PO4) und Kohlensäure (H.zweiCO3) haben so viele pK-Wertezu wie Protonen freisetzen können. So ist die H.3PO4 hat drei pKzu (2.12, 7.21 und 12.67) und der H.zweiCO3 hat zwei (6.352 und 10.329).
Wenn Sie in einer Lösung einen pH-Wert von 3 beibehalten möchten, können Sie zwischen HCOONa / HCOOH (pK) wählenzu= 3,68) und NaHzweiPO4/ H.3PO4 (pKzu= 2,12).
Der erste Puffer, der der Ameisensäure, liegt näher an pH 3 als der Phosphorsäurepuffer; Daher puffern HCOONa / HCOOH bei pH 3 besser als NaHzweiPO4/ H.3PO4.
Verweise
- Day, R. & Underwood, A.. Quantitative analytische Chemie (fünfte Ausgabe). PEARSON Prentice Hall, S. 188-194.
- Avsar Aras. (20. April 2013). Mini-Stoßdämpfer. Abgerufen am 9. Mai 2018 von: commons.wikimedia.org
- Wikipedia. (2018). Pufferlösung. Abgerufen am 9. Mai 2018 von: en.wikipedia.org
- Assoc. Prof. Lubomir Makedonski, PhD. [Dok.]. Pufferlösungen. Medizinische Universität von Varna.
- Chem Collective. Puffer-Tutorials. Abgerufen am 9. Mai 2018 von: chemcollective.org
- askIITians. (2018). Pufferlösung. Abgerufen am 9. Mai 2018 von: askiitians.com
- Quimicas.net (2018). Beispiele für Puffer, Puffer oder Pufferlösungen. Abgerufen am 9. Mai 2018 von: quimicas.net



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.