
Bildung, Eigenschaften und Anwendungen von Diazoniumsalzen
Das Diazoniumsalze sind organische Verbindungen, bei denen ionische Wechselwirkungen zwischen der Azogruppe (-N) bestehenzwei+) und ein Anion X.- (Cl-, F.-, CH3GURREN-, usw.). Seine allgemeine chemische Formel lautet RNzwei+X.-, und dabei kann die Seitenkette R durchaus eine aliphatische Gruppe oder eine Arylgruppe sein; ein aromatischer Ring.
Das untere Bild zeigt die Struktur des Arendiazoniumions. Die blauen Kugeln entsprechen der Azogruppe, während die schwarzen und weißen Kugeln den aromatischen Ring der Phenylgruppe bilden. Die Azogruppe ist sehr instabil und reaktiv, da eines der Stickstoffatome eine positive Ladung (-N) aufweist+≡N).
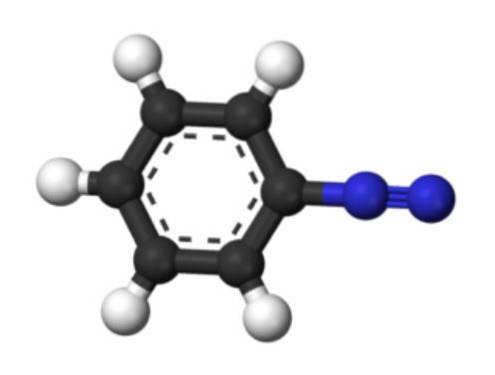
Es gibt jedoch Resonanzstrukturen, die diese positive Ladung beispielsweise am benachbarten Stickstoffatom delokalisieren: -N = N.+. Dies entsteht, wenn ein Elektronenpaar, das eine Bindung bildet, zum Stickstoffatom auf der linken Seite gelangt.
Ebenso kann diese positive Ladung durch das Pi-System des aromatischen Rings delokalisiert werden. Infolgedessen sind aromatische Diazoniumsalze stabiler als aliphatische, da die positive Ladung nicht entlang einer Kohlenstoffkette (CH) delokalisiert werden kann3, CHzweiCH3, usw.).
Artikelverzeichnis
- 1 Schulung
- 2 Eigenschaften
- 2.1 Verdrängungsreaktionen
- 2.2 Sonstige Verschiebungen
- 2.3 Redoxreaktionen
- 2.4 Photochemische Zersetzung
- 2.5 Azokupplungsreaktionen
- 3 Anwendungen
- 4 Referenzen
Ausbildung
Diese Salze stammen aus der Reaktion eines primären Amins mit einem Säuregemisch aus Natriumnitrit (NaNO)zwei).
Sekundäre Amine (R.zweiNH) und tertiär (R.3N) andere stickstoffhaltige Produkte wie N-Nitrosoamine (die gelbliche Öle sind), Aminsalze (R.3HN+X.-) und N-Nitrosoammoniumverbindungen.
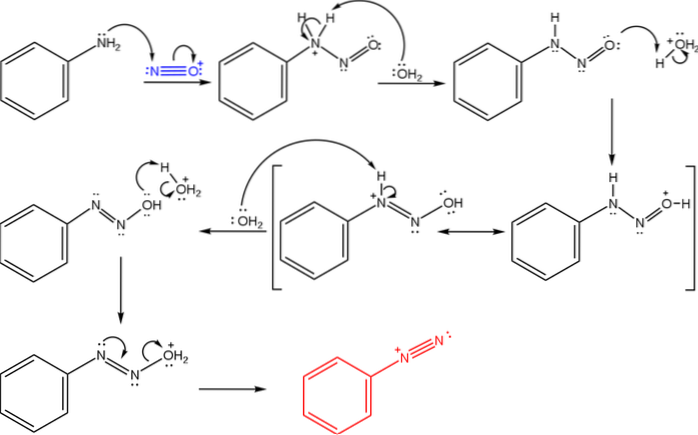
Das obere Bild zeigt den Mechanismus, durch den die Bildung von Diazoniumsalzen gesteuert wird oder der auch als Diazotierungsreaktion bekannt ist.
Die Reaktion beginnt mit Phenylamin (Ar-NHzwei), die einen nukleophilen Angriff auf das N-Atom des Nitrosoniumkations (NO+). Dieses Kation wird durch die Mischung NaNO erzeugtzwei/ HX, wobei X im Allgemeinen Cl ist; d.h. HCl.
Die Bildung des Nitrosoniumkations setzt Wasser in das Medium frei, wodurch ein Proton aus dem positiv geladenen Stickstoff entfernt wird..
Dann dasselbe Wassermolekül (oder eine andere saure Spezies als H.3ODER+) liefert ein Proton zu Sauerstoff, wodurch die positive Ladung am weniger elektronegativen Stickstoffatom delokalisiert wird).
Jetzt deprotoniert das Wasser wieder den Stickstoff und erzeugt so das Diazohydroxidmolekül (das vorletzte in der Sequenz)..
Da das Medium sauer ist, wird das Diazohydroxid von der OH-Gruppe entwässert; Um der elektronischen Leerstelle entgegenzuwirken, bildet das freie N-Paar die Dreifachbindung der Azogruppe.
So ist am Ende des Mechanismus Benzoldiazoniumchlorid (C.6H.5N.zwei+Cl-, das gleiche Kation aus dem ersten Bild).
Eigenschaften
Im Allgemeinen sind Diazoniumsalze farblos und kristallin, löslich und bei niedrigen Temperaturen (weniger als 5 ° C) stabil..
Einige dieser Salze sind so empfindlich gegenüber mechanischen Stößen, dass jede physikalische Manipulation sie zur Detonation bringen könnte. Schließlich reagieren sie mit Wasser unter Bildung von Phenolen.
Verdrängungsreaktionen
Diazoniumsalze sind potenzielle Freisetzer von molekularem Stickstoff, dessen Bildung der gemeinsame Nenner bei Verdrängungsreaktionen ist. In diesen verdrängt eine Spezies X die instabile Azogruppe und entweicht als N.zwei(G).
Sandmeyer-Reaktion
ArNzwei+ + CuCl => ArCl + N.zwei + Cu+
ArNzwei+ + CuCN => ArCN + N.zwei + Cu+
Gatterman-Reaktion
ArNzwei+ + CuX => ArX + N.zwei + Cu+
Im Gegensatz zur Sandmeyer-Reaktion weist die Gatterman-Reaktion anstelle ihres Halogenids metallisches Kupfer auf; das heißt, das CuX wird erzeugt vor Ort.
Schiemann-Reaktion
[ArNzwei+] BF4- => ArF + BF3 + N.zwei
Die Schiemann-Reaktion ist durch die thermische Zersetzung von Benzoldiazoniumfluorborat gekennzeichnet.
Gomberg Bachmann Reaktion
[ArNzwei+] Cl- + C.6H.6 => Ar - C.6H.5 + N.zwei + HCl
Andere Verschiebungen
ArNzwei+ + KI => ArI + K.+ + N.zwei
[ArNzwei+] Cl- + H.3POzwei + H.zweiO => C.6H.6 + N.zwei + H.3PO3 + HCl
ArNzwei+ + H.zweiO => ArOH + N.zwei + H.+
ArNzwei+ + Stempelzwei => ArNOzwei + N.zwei + Cu+
Redoxreaktionen
Diazoniumsalze können unter Verwendung einer Mischung aus SnCl zu Arylhydrazinen reduziert werdenzwei/ HCl:
ArNzwei+ => ArNHNHzwei
Sie können auch in stärkeren Reduktionen mit Zn / HCl zu Arylaminen reduziert werden:
ArNzwei+ => ArNHzwei + NH4Cl
Photochemische Zersetzung
[ArNzwei+] X.- => ArX + N.zwei
Diazoniumsalze sind empfindlich gegen Zersetzung durch Einfall von ultravioletter Strahlung oder bei sehr engen Wellenlängen.
Azokupplungsreaktionen
ArNzwei+ + Ar'H → ArNzweiAr '+ H.+
Diese Reaktionen sind vielleicht die nützlichsten und vielseitigsten der Diazoniumsalze. Diese Salze sind schwache Elektrophile (der Ring delokalisiert die positive Ladung der Azogruppe). Damit sie mit aromatischen Verbindungen reagieren können, müssen sie negativ geladen werden, wodurch Azosverbindungen entstehen..
Die Reaktion findet mit einer effizienten Ausbeute zwischen einem pH von 5 und 7 statt. Bei saurem pH ist die Kupplung niedriger, da die Azogruppe protoniert ist, was es unmöglich macht, den negativen Ring anzugreifen..
Ebenso reagiert das Diazoniumsalz bei einem basischen pH-Wert (größer als 10) mit dem OH- um Diazohydroxid herzustellen, das relativ inert ist.
Strukturen dieser Art von organischer Verbindung haben ein sehr stabiles konjugiertes Pi-System, dessen Elektronen Strahlung im sichtbaren Spektrum absorbieren und emittieren..
Folglich zeichnen sich Azoverbindungen dadurch aus, dass sie bunt sind. Aufgrund dieser Eigenschaft wurden sie auch als Azofarbstoffe bezeichnet.
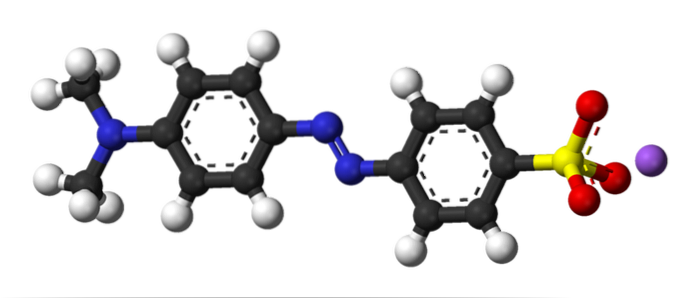
Das obige Bild zeigt das Konzept der Azokupplung mit Methylorange als Beispiel. In der Mitte seiner Struktur ist die Azogruppe als Verbinder der beiden aromatischen Ringe zu sehen.
Welcher der beiden Ringe war das Elektrophil zu Beginn der Kopplung? Die rechts, weil die Sulfonatgruppe (-SO3) entfernt die Elektronendichte aus dem Ring und macht ihn noch elektrophiler.
Anwendungen

Eine der kommerziellsten Anwendungen ist die Herstellung von Farbstoffen und Pigmenten, die auch die Textilindustrie beim Färben von Stoffen umfasst. Diese Azoverbindungen verankern sich an bestimmten molekularen Stellen auf dem Polymer und färben es farbig.
Aufgrund seiner photolytischen Zersetzung wird es (weniger als zuvor) zur Reproduktion von Dokumenten verwendet. Wie? Die Bereiche des Papiers, die mit einem speziellen Kunststoff bedeckt sind, werden entfernt und anschließend mit einer basischen Phenollösung versehen, wobei die Buchstaben oder das Design blau gefärbt werden..
In organischen Synthesen werden sie als Ausgangspunkte für viele aromatische Derivate verwendet.
Schließlich haben sie Anwendungen auf dem Gebiet der intelligenten Materialien. In diesen sind sie kovalent an eine Oberfläche gebunden (z. B. Gold), so dass diese auf äußere physikalische Reize chemisch reagieren kann..
Verweise
- Wikipedia. (2018). Diazoniumverbindung. Abgerufen am 25. April 2018 von: en.wikipedia.org
- Francis A. Carey. Organische Chemie. Carbonsäuren. (sechste Ausgabe, Seiten 951-959). Mc Graw Hill.
- Graham Solomons T. W., Craig B. Fryhle. Organische Chemie. Amine. (10. Ausgabe, Seiten 935-940). Wiley plus.
- Clark J. (2016). Reaktionen von Diazoniumsalzen. Abgerufen am 25. April 2018 von: chemguide.co.uk
- BYJU'S. (05. Oktober 2016). Diazoniumsalze und ihre Anwendungen. Abgerufen am 25. April 2018 von: byjus.com
- TheGlobalTutors. (2008-2015). Eigenschaften von Diazoniumsalzen. Abgerufen am 25. April 2018 von: theglobaltutors.com
- Ahmad et al. (2015). Polymer. Abgerufen am 25. April 2018 von: msc.univ-paris-diderot.fr
- CytochromT. (15. April 2017). Mechanismus zur Bildung des Benzoldiazoniumions. Abgerufen am 25. April 2018 von: commons.wikimedia.org
- Jacques Kagan. (1993). Organische Photochemie: Prinzipien und Anwendungen. Academic Press Limited, Seite 71. Abgerufen am 25. April 2018 von: books.google.co.ve



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.