
Safranineigenschaften, Verwendung, Techniken, Toxizität
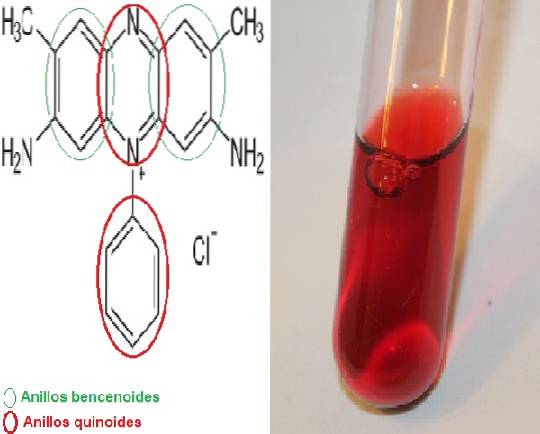
Das Safranin Es ist ein Meriquinoidfarbstoff, der nach seiner chemischen Struktur 2 Benzoloidringe und 2 Quinoidringe benannt ist, wobei letztere die rote Farbe liefern.
Es wird in seiner Kurzform auch als Dimethylsafanin oder basisches Rot 2 bezeichnet, da sein wissenschaftlicher Name 3,7-Diamino-2,8-dimethyl-5-phenylphenaziniumchlor-dimethylsafanin lautet und die chemische Formel C lautetzwanzigH.19N.4 Cl.
Es gibt eine Variante namens Trimethyl-Safranin, aber es gibt keinen signifikanten Unterschied zwischen den beiden Substanzen.
Safranin ist ein monochromatischer Farbstoff und abhängig von den Eigenschaften der chemischen Formel eine positiv geladene Substanz. Daher hat es eine Affinität zu negativ geladenen Strukturen. Diese Strukturen werden rot gefärbt.
Diese Eigenschaft gibt ihm die Anwendbarkeit in vielen histologischen Techniken, um verschiedene Zellstrukturen sowohl in eukaryotischen als auch in prokaryotischen Organismen zu färben..
Safranin wird als Kontrastmittel in wichtigen und bekannten Techniken zur routinemäßigen Verwendung in der Bakteriologie verwendet. Diese Techniken sind unter anderem: die Gram-Hucker-Färbung, die Schaeffer-Fulton-Färbung für Sporen oder die Färbung von Bakterienkapseln..
Artikelverzeichnis
- 1 Funktionen
- 2 Verwenden Sie
- 3 Techniken auf dem Gebiet der Bakteriologie
- 3.1 Castañeda-Färbung zur Rickettsienfärbung
- 3.2 Modifizierte Koster-Färbung für Brucella
- 3.3 Färbung von Bakterienkapseln
- 3.4 Schaeffer Fulton Sporenfärbung
- 3,5 Gramm-Hucker-Fleck
- 4 Techniken auf dem Gebiet der Histologie
- 4.1 Kulchitsky-Zellfärbung (Enterochromaffine)
- 4.2 Färbung zum Nachweis von Arthrose
- 4.3 Färbung zur Identifizierung von Makroalgen
- 5 Toxizität
- 6 Referenzen
Eigenschaften
Die Farbe des Safrans (ein Gewürz, das aus den Narben der Blume von gewonnen wird Crocus sativus) war die Inspiration, diese Färbung zu benennen. Vom Begriff Safran kommt der Name Safranin. Dies ist auf die große Ähnlichkeit zwischen der Farbe des Safrans und der Farbe zurückzuführen, die dieser Farbstoff liefert..
Safranin wird als Kristalle oder in Pulverform erhalten, wobei beide Darstellungen in Wasser löslich sind. Der Safraninfarbstoff ist geruchlos. Flecken Strukturen rot. Die Strukturen, die Safraninfarbstoff anziehen, werden Safranophile genannt..
Strukturell ist Safranin komplex, es hat zwei Benzoloidringe an den Enden und in der Mitte befinden sich die beiden Quinoidringe, an denen sich das N-Kation befindet.+. Das Zentrum der Struktur ist das System, das für die Bereitstellung der Farbe zuständig ist. Aufgrund dieser Eigenschaft wird dieser Farbstoff in die Kategorie II eingestuft..
Benutzen
Safranin wird verwendet, um verschiedene Strukturen zu färben. Besonders hervorzuheben sind die im Magen-Darm-Trakt vorhandenen Kulchitsky-Zellen, auch Enterochromaffinzellen genannt.
Es ist in der Lage, zur Familie gehörende Mikroorganismen zu färben Rickettsiaceae. Ebenso wird es in verschiedenen Techniken verwendet, wie beispielsweise der Koster-Methode, einer Modifikation, die zur Färbung von Bakterien der Gattung verwendet wird Brucella.
Andererseits wird Safranin in der Schaeffer-Fulton-Sporenfärbungstechnik und in der Gram-Hucker-Färbung verwendet. Bei beiden Techniken wirkt Safranin als Kontrastmittel.
Im ersten Fall nehmen die Sporen die Farbe von Malachitgrün an und der Rest der Strukturen ist durch Safranin rot. Im zweiten Fall verlieren die gramnegativen Bakterien im Verfärbungsschritt die Farbe des violetten Kristalls, daher ist Safranin derjenige, der die gramnegativen Bakterien rot färbt.
Zusätzlich wird Safranin in der Bakteriologie verwendet, um Brucella-Agarmedien mit einer 1: 5000-Verdünnung von Safranin herzustellen. Dieses Medium dient zur Unterscheidung der Arten Brucella suis der übrigen Arten. Brucella melitensis Y. Brucella abortus Sie wachsen aber in dieser Umgebung B. suis ist gehemmt.
Im agroindustriellen Bereich wurde Safranin zu 2,25% verwendet und 1:10 verdünnt, um Stammproben der Zuckerrohrpflanze zu färben.
Diese Pflanze ist häufig von den Bakterien betroffen Leifsonia xyli subsp. xyli, wer beschädigt das Xylem der Pflanze. Die gefärbten Stämme werden ausgewertet, um die Funktion der Xylemgefäße zu bestimmen..
Techniken auf dem Gebiet der Bakteriologie
Castañeda-Färbung zum Färbenickettsiae
Ein Blut- oder Gewebeabstrich wird in eine Pufferlösung (Phosphatpuffer pH 7,6) gegeben. Man lässt es spontan trocknen und bedeckt es dann 3 Minuten lang mit Methylenblau und färbt es mit Safranin gegen. Rickettsien sind blau gefärbt und kontrastieren mit dem roten Hintergrund.
Koster Fleck modifiziert für Brucella
Ein Abstrich wird gemacht und im Feuerzeug zur Fixierung geflammt. Anschließend wird es 1 Minute lang mit einer Mischung aus 2 Teilen wässrigem Safranin bedeckt, das mit 3 Teilen 1 mol / l KOH-Lösung gesättigt ist. Es wird mit destilliertem Wasser gewaschen und mit 1% Carbolmethylenblau gegengefärbt..
Wenn die Probe Bakterien der Gattung enthält Brucella Diese werden auf blauem Hintergrund orange angezeigt.
Färbung der Bakterienkapsel
Eine Mischung aus Bakteriensuspension wird mit Tusche hergestellt und mit Safranin versetzt. Unter dem Mikroskop wird um jede Bakterienkapsel mit einem schwarzen Hintergrund ein rötlicher Lichthof beobachtet..
Sporenfärbung Schaeffer Fulton
Mit der Bakteriensuspension wird ein Abstrich gemacht. Dann wird es zum Erhitzen fixiert. Es ist mit 5% Malachitgrün bedeckt und flammt häufig, bis Dämpfe freigesetzt werden. Der Vorgang wird 6-10 Minuten wiederholt. Schließlich wird es mit Wasser gewaschen und 30 Sekunden mit 0,5% Safranin gegengefärbt. Bacilli färben sich rot und Sporen grün.
Gram-Hucker-Fleck
Ein Abstrich wird mit Bakteriensuspension gemacht und auf Hitze fixiert. Decken Sie den Objektträger 1 Minute lang mit Kristallviolett ab. Dann wird Lugol 1 Minute lang als Beizlösung gegeben. Anschließend wird es mit Acetonalkohol gebleicht und schließlich 30 Sekunden mit Safranin gegengefärbt..
Grampositive Bakterien färben bläulichviolett und gramnegative Bakterien rot.
Einige Labors verwenden die Gram-Hucker-Technik nicht mehr, um die modifizierte Gram-Kopeloff-Technik anzuwenden. In letzterem wird Safranin durch basisches Fuchsin ersetzt. Dies liegt daran, dass Safranin Arten der Gattungen schwach färbt Legionellen, Campylobacter Y. Brucella.
Techniken auf dem Gebiet der Histologie
Kulchitsky-Zellfärbung (Enterochromaffine)
Gewebeschnitte aus dem Magen-Darm-Trakt werden mit Silberchlorid angefärbt. Es wird dann mit Natriumthiosulfat entfärbt und schließlich mit Safranin gegengefärbt.
Kulchitsky-Zellen zeichnen sich durch das Vorhandensein von schwarzbraunem Granulat aus..
Arthrose Fleck
Da Safranin eine positive Ladung hat, bindet es sehr gut an die Carboxyl- und Sulfatgruppen von Glycosaminoglycanen. Diese sind Teil der Proteoglykane, aus denen der Gelenkknorpel besteht. In diesem Sinne kann beim Anfärben mit Safranin O festgestellt werden, ob ein Knorpelverlust vorliegt oder nicht..
Der Verlust von Knorpelgewebe kann mit der Mankin-Skala oder auch als Arthrose-Skala bezeichnet werden..
Die Technik wird nachfolgend erläutert: Der histologische Abschnitt wird in eine Schale mit Weigerts Eisenhämatoxylinlösung getaucht, dann durch sauren Alkohol geleitet und mit Wasser gewaschen.
Setzen Sie den Färbevorgang fort, indem Sie den Objektträger in schnelles Grün tauchen, ihn mit Essigsäure waschen und jetzt in Safranin O eintauchen. Zum Abschluss des Vorgangs wird er mit Alkoholen in unterschiedlichen Konzentrationen in aufsteigender Reihenfolge dehydratisiert. Der letzte Schritt erfordert Xylol oder Xylol, damit die Probe geklärt werden kann.
Die Objektträger werden mit Kanada-Balsam oder ähnlichem konditioniert, um unter einem Mikroskop beobachtet zu werden..
Bei dieser Technik werden die Kerne schwarz gefärbt, der Knochen grün und der Knorpel, wo sich die Proteoglykane befinden, rot.
Färbung zur Identifizierung von Makroalgen
Pérez et al. Schlugen 2003 eine einfache und kostengünstige Technik zum Färben von Makroalgen vor. Die Proben werden in histologischen Paraffinschnitten hergestellt. Die Schnitte werden mit 1% Glycerin fixiert, so dass sie vollständig trocknen können. Es wird dann in Xylol gegeben, um das Paraffin zu entfernen.
Der Abschnitt wird rehydratisiert, indem er durch eine Reihe von Schalen geführt wird, die Ethanol in verschiedenen Konzentrationsgraden (absteigende Reihenfolge) enthalten, jeweils 2 Minuten lang..
Anschließend wird es 5 Minuten mit einer 3: 1-Mischung aus 1% Safranin und 1% Toluidinblau gefärbt, die beide mit 50% Ethanol hergestellt wurden. Der Mischung werden drei Tropfen Pikrinsäure zugesetzt, die als Beizmittel wirkt..
Dann wird es dehydriert, indem man die Alkoholschalen erneut durchläuft, diesmal jedoch in aufsteigender Weise. Schließlich wird es mit Xylol gespült und die Probe mit zu beobachtendem Kanada-Balsam hergestellt..
Toxizität
Glücklicherweise ist Safranin ein Farbstoff, der für diejenigen, die damit umgehen, keine Gefahr darstellt. Es ist ein harmloser Farbstoff, nicht krebserregend und nicht brennbar..
Direkter Kontakt mit der Haut oder den Schleimhäuten kann ohne größere Komplikationen zu einer leichten Rötung des Bereichs führen. Zu diesem Zweck wird empfohlen, den betroffenen Bereich mit viel Wasser zu waschen.
Verweise
- García H. Safranin Farbstoff O.. Gesundheitstechniker, 2012; 1 (2): 83 & ndash; 85. Verfügbar unter: medigraphic.com
- Gil M. Gram Fleck: Grundierung, Materialien, Technik und Verwendung. 2019. Verfügbar unter: lifeder.com
- Gil M. Sporenfärbung: Gründe, Techniken und Verwendungen. 2019. Verfügbar unter: lifeder.com
- Safranina. " Wikipedia, die freie Enzyklopädie. 7. März 2017, 10:39 UTC. 3. August 2019, 20:49 Uhr en.wikipedia.org
- Pérez-Cortéz S., Vera B., Sánchez C. Nützliche Farbtechnik bei der anatomischen Interpretation von Gracilariopsis tenuifrons Y. Gracilaria chilensis (Rhodophyta). Minuten Bot. Venez. 2003; 26 (2): 237 & ndash; 244. Verfügbar unter: scielo.org.
- Iglesia Aleika, Peralta Esther Lilia, Alvarez Elba, Milián J., Matos Madyu. Beziehung der Funktionalität der Xylemgefäße und der Anwesenheit von Leifsonia xyli subsp. xyli. Rev. Veg Schutz. 2007; 22 (1): 65 & ndash; 65. Verfügbar unter: scielo.sld



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.