
Resistin Eigenschaften, Struktur, Funktionen
Das widerstehen, Es ist ein Peptidhormon, das reich an Cystein ist und auch als Fettgewebespezifischer Sekretionsfaktor (ADSF) bekannt ist. Sein Name ist auf die positive Korrelation (Resistenz) zurückzuführen, die er gegenüber der Wirkung von Insulin aufweist. Es ist ein Zytokin mit 10 bis 11 Cysteinresten.
Es wurde 2001 in Fettzellen (Fettgewebe) von Mäusen sowie in Immun- und Epithelzellen von Menschen, Hunden, Schweinen, Ratten und verschiedenen Arten von Primaten entdeckt..
Artikelverzeichnis
- 1 Allgemeine Merkmale
- 1.1 Bei Mäusen
- 1.2 Beim Menschen
- 2 Synonymie
- 3 Entdeckung
- 3.1 FIZZ3
- 3.2 ADSF
- 3.3 Resistin
- 4 Strukturen
- 5 Funktionen
- 6 Krankheiten
- 7 Referenzen
Allgemeine Charakteristiken
Resistin gehört zu einer Familie von Molekülen vom Resistin-Typ (Resistin-ähnliche Moleküle, RELMs). Alle Mitglieder der RELM-Familie präsentieren eine N-terminale Sequenz, die das Sekretionssignal zwischen 28 und 44 Resten darstellt.
Sie haben eine variable zentrale Region oder Zone mit einem carboxylterminalen Ende einer Domäne, die zwischen 57 und etwa 60 Resten variiert, hoch konserviert oder konserviert ist und reichlich Cystein enthält.
Dieses Protein wurde in mehreren Säugetieren gefunden. Die meiste Aufmerksamkeit wurde auf Resistin gerichtet, das von Mäusen ausgeschieden wird und beim Menschen vorhanden ist. Diese beiden Proteine weisen eine Ähnlichkeit (Homologie) von 53 bis 60% in ihren Aminosäuresequenzen auf..
In Mäusen
Bei diesen Säugetieren sind Fettzellen oder weißes Fettgewebe die Hauptquelle für Resistin.
Resistin bei Mäusen ist reich an 11 kDa Cystein. Das Gen für dieses Protein befindet sich auf dem achten (8) Chromosom. Es wird als Vorläufer mit 114 Aminosäuren synthetisiert. Sie haben auch eine Signalsequenz mit 20 Aminosäuren und ein reifes Segment mit 94 Aminosäuren..
Strukturelles Resistin in Mäusen hat fünf Disulfidbindungen und mehrere β-Windungen. Es kann dank der Disulfid- und Nicht-Disulfid-Bindungen Komplexe aus zwei identischen Molekülen (Homodimeren) oder Proteine mit quaternären Strukturen (Multimeren) unterschiedlicher Größe bilden.
In Menschen
Humanes Resistin ist dadurch gekennzeichnet, dass es wie bei Mäusen oder anderen Tieren ein Peptidprotein ist, das reich an Cystein ist, nur beim Menschen beträgt es 12 kDa mit einer reifen Sequenz von 112 Aminosäuren.
Das Gen für dieses Protein befindet sich auf Chromosom 19. Die Resistinquelle beim Menschen sind Makrophagenzellen (Zellen des Immunsystems) und Epithelgewebe. Zirkuliert im Blut als dimeres Protein mit 92 Aminosäuren, die durch Disulfidbindungen verbunden sind.

Synonymie
Resistin ist unter mehreren Namen bekannt, darunter: Cystein-reiches sekretiertes Protein FIZZ3 (Cystein-reiches sekretiertes Protein FIZZ3), Fettgewebespezifischer Sekretionsfaktor (ADSF), Fettgewebespezifischer Sekretionsfaktor (ADSF), Protein, das reich an C / EBP ist -epsilon-reguliertes myeloidspezifisches sekretiertes cysteinreiches Protein, sekretiertes cysteinreiches Protein A12-alpha-like 2 (Cystein-reiches sekretiertes Protein A12-alpha-like 2), RSTN, XCP1, RETN1, MGC126603 und MGC126609.
Entdeckung
Dieses Protein ist für die wissenschaftliche Gemeinschaft relativ neu. Es wurde zu Beginn dieses Jahrhunderts von drei Gruppen von Wissenschaftlern unabhängig voneinander entdeckt, die ihm unterschiedliche Namen gaben: FIZZ3, ADSF und Resistin..
FIZZ3
Es wurde im Jahr 2000 in entzündetem Lungengewebe entdeckt. Drei Gene von Mäusen und zwei homologe Gene von Menschen, die mit der Produktion dieses Proteins assoziiert sind, wurden identifiziert und beschrieben..
ADSF
Protein entdeckt im Jahr 2001 dank der Identifizierung eines Sekretionsfaktors, der reich an Cystin (Ser / Cys) (ADSF) ist, das für weißes Lipidgewebe (Adiposites) spezifisch ist.
Diesem Protein wurde eine wichtige Rolle bei der Differenzierung von multipotenten Zellen zu reifen Adipositen zugewiesen (Adipogenese)..
Resistin
Ebenfalls im Jahr 2001 beschrieb eine Gruppe von Forschern dasselbe cystinreiche Protein im reifen Lipidgewebe von Mäusen, das sie aufgrund seiner Insulinresistenz Resistin nannten..
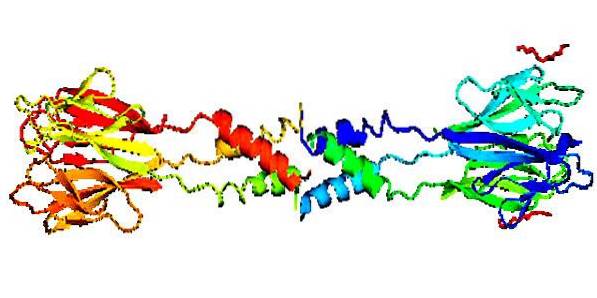
Strukturen
Strukturell ist bekannt, dass dieses Protein aus einem laminar geformten Vorder- oder Kopfbereich und einem helixförmigen hinteren Bereich (Schwanz) besteht, die Oligomere mit unterschiedlichen Molekulargewichten bilden, je nachdem, ob es sich um einen Menschen oder einen anderen Ursprung handelt..
Es hat eine zentrale Region mit 11 Resten von Ser / Cys (Serin / Cystein) und einen Bereich, der auch reich an Ser / Cys ist, dessen Sequenz CX11CX8CXCX3CX10CXCXCX9CCX3-6 ist, wobei C Ser / Cys und X eine beliebige Aminosäure ist.
Es hat eine strukturelle Zusammensetzung, die als ungewöhnlich angesehen wird, da es aus mehreren Untereinheiten besteht, die durch nichtkovalente Wechselwirkungen verbunden sind, dh sie verwenden keine Elektronen, sondern dispergierte elektromagnetische Variationen, um ihre Struktur zu bilden..
Eigenschaften
Die Funktionen von Resistin sind bis heute Gegenstand umfangreicher wissenschaftlicher Debatten. Zu den wichtigsten Befunden der biologischen Wirkungen bei Menschen und Mäusen gehören:
- Mehrere Gewebe bei Menschen und Mäusen reagieren auf Resistin, einschließlich Leber-, Muskel-, Herz-, Immun- und Fettzellen.
- Hyperresistinämische Mäuse (dh mit erhöhten Resistinspiegeln) erfahren eine beeinträchtigte Glukose-Selbstregulation (Homöostase)..
- Resistin verringert die Insulin-stimulierte Glukoseaufnahme in Herzmuskelzellen.
- In Immunzellen (Makrophagen) des Menschen induziert Resistin die Produktion von Proteinen, die die Reaktion des Immunsystems koordinieren (entzündliche Zytokine).
Krankheiten
Es wird angenommen, dass dieses Protein beim Menschen physiologisch zur Insulinresistenz bei Diabetes mellitus beiträgt..
Die Rolle, die es bei Fettleibigkeit spielt, ist noch unbekannt, obwohl festgestellt wurde, dass es eine Korrelation zwischen erhöhtem Fettgewebe und Resistinspiegeln gibt, dh Fettleibigkeit erhöht die Konzentration von Resistin im Körper. Es wurde auch gezeigt, dass es für einen hohen Gehalt an schlechtem Cholesterin im Blut verantwortlich ist.
Resistin moduliert molekulare Wege bei entzündlichen und Autoimmunerkrankungen. Es verursacht direkt die funktionelle Veränderung des Endothels, was wiederum zu einer Verhärtung der Arterien führt, die auch als Atheroschlorose bezeichnet wird.
Resistin wirkt als Indikator für Krankheiten und sogar als prädiktives klinisches Instrument für Herz-Kreislauf-Erkrankungen. Es ist unter anderem an der Produktion von Blutgefäßen (Angiogenese), Thrombose, Asthma, alkoholfreier Fettlebererkrankung und chronischer Nierenerkrankung beteiligt.
Verweise
- DC Juan, L.S. Kan, C.C. Huang, S.S. Chen, L.T. Ho, L.C. Au (2003). Herstellung und Charakterisierung von bioaktivem rekombinantem Resistin in Escherichia coli. Zeitschrift für Biotechnologie.
- Menschlicher Widerstand. Pospec. Von prospecbio.com wiederhergestellt.
- S. Abramson. Resistim. Von collab.its.virginia.edu wiederhergestellt.
- G. Wolf (2004), Insulinresistenz und Fettleibigkeit: Resistin, ein Hormon, das vom Fettgewebe ausgeschüttet wird. Ernährungsberichte.
- M. Rodríguez Pérez (2014), Untersuchung der biologischen Funktionen von S-Resistin. Bericht an die Universität von Castilla-La Mancha, um den Titel eines Doktors in Biochemie zu beantragen. 191.
- A. Souki, N.J. Arráiz-Rodríguez, C. Prieto-Fuenmayor,… C. Cano-Ponce (2018), Grundlegende Aspekte bei Fettleibigkeit. Barranquilla, Kolumbien: Simón Bolívar University Editions. 44 p.
- Md.S. Jamaluddin, S.M. Weakley, Q. Yao & C. Chen (2012). Resistin: funktionelle Rollen und therapeutische Überlegungen bei Herz-Kreislauf-Erkrankungen. British Journal of Pharmacology.
- Ich habe mich gewehrt. Von en.wikipedia.org wiederhergestellt.
- DR. Schwartz, M.A. Lazar (2011). Humanes Resistin: Gefunden in der Übersetzung von Maus zu Mensch. Trends in der Endokrinologie und im Stoffwechsel.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.