
Keratin-Typen, Struktur, Ort und Funktionen
Das Keratin Es ist ein unlösliches faseriges Protein, das ein struktureller Bestandteil von Zellen und Integumenten vieler Organismen ist, insbesondere von Wirbeltieren. Es hat sehr unterschiedliche Formen und ist chemisch gesehen nicht sehr reaktiv.
Seine Struktur wurde erstmals 1951 von den Wissenschaftlern Linus Pauling und Robert Corey beschrieben, während sie die Struktur von Tierhaaren analysierten. Diese Forscher gaben auch Einblicke in die Struktur von Myosin im Muskelgewebe.
Nach Kollagen ist es eines der wichtigsten Proteine bei Tieren und macht den größten Teil des Trockengewichts von Haaren, Wolle, Nägeln, Krallen und Hufen, Federn, Hörnern und einem wesentlichen Teil der äußeren Hautschicht aus.
Die Elemente oder "keratinisierten" Teile von Tieren können sehr unterschiedliche Morphologien aufweisen, die in hohem Maße von der Funktion abhängen, die sie in jedem bestimmten Organismus erfüllen.
Keratin ist ein Protein mit Eigenschaften, die ihm eine große mechanische Effizienz in Bezug auf Spannung und Kompression verleihen. Es wird von einem speziellen Zelltyp produziert, der "Keratinozyten" genannt wird und normalerweise stirbt, nachdem sie produziert wurden..
Einige Autoren geben an, dass Keratine gewebe- und stadienspezifisch exprimiert werden. Beim Menschen gibt es mehr als 30 Gene, die für diese Proteine kodieren, und sie gehören zu einer Familie, die sich durch mehrere Runden genetischer Duplikation entwickelt hat.
Artikelverzeichnis
- 1 Arten von Keratinen und ihre Struktur
- 1.1 α-Keratine
- 1.2 Weiche und harte Keratine
- 1,3 β-Keratine
- 2 Wo ist es und welche Funktionen hat es??
- 2.1 In Schutz und Deckung
- 2.2 In der Verteidigung und anderen Funktionen
- 2.3 Unterwegs
- 2.4 In der Industrie
- 3 Referenzen
Keratin-Typen und ihre Struktur
Es gibt im Wesentlichen zwei Arten von Keratinen: α und β. Diese zeichnen sich durch eine Grundstruktur aus, die hauptsächlich aus Polypeptidketten besteht, die sich als Alpha-Helices (α-Keratine) aufwickeln oder sich parallel als β-gefaltete Blätter (β-Keratine) verbinden können..
α-Keratine
Diese Art von Keratin ist die am meisten untersuchte und es ist bekannt, dass Säugetiere mindestens 30 verschiedene Varianten dieser Art von Keratin haben. Bei diesen Tieren sind α-Keratine Teil von Nägeln, Haaren, Hörnern, Hufen, Federkielen und Epidermis.
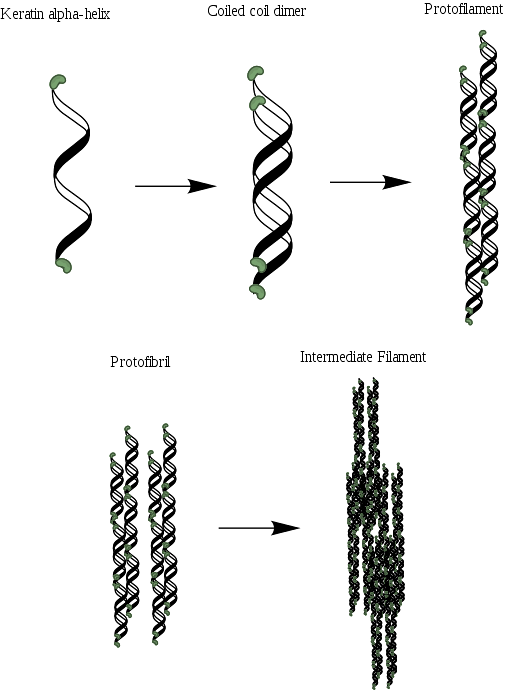
Wie Kollagen enthalten diese Proteine in ihrer Struktur einen reichlichen Anteil kleiner Aminosäuren wie Glycin und Alanin, die die Bildung von Alpha-Helices ermöglichen. Die Molekülstruktur eines α-Keratins besteht aus drei verschiedenen Regionen: (1) den kristallinen Fibrillen oder Helices, (2) den terminalen Domänen der Filamente und (3) der Matrix..
Die Helices sind zwei und bilden ein Dimer, das einer gewundenen Spirale ähnelt, die dank der Anwesenheit von Bindungen oder Disulfidbrücken (S-S) zusammengehalten wird. Jede der Helices hat in jeder Runde ungefähr 3,6 Aminosäurereste und besteht aus ungefähr 310 Aminosäuren..
Diese gewickelten Spulen können dann verbunden werden, um eine Struktur zu bilden, die als Protofilament oder Protofibrille bekannt ist und die Fähigkeit hat, sich mit anderen des gleichen Typs zusammenzusetzen..
Protofilamente besitzen nicht helikale N- und C-terminale Enden, die reich an Cysteinresten sind und an die Kern- oder Matrixregion gebunden sind. Diese Moleküle polymerisieren unter Bildung von Zwischenfilamenten mit einem Durchmesser nahe 7 nm..
Es werden zwei Arten von Zwischenfilamenten aus Keratin unterschieden: saure Zwischenfilamente (Typ I) und basische (Typ II). Diese sind in eine Proteinmatrix eingebettet und die Art und Weise, wie diese Filamente angeordnet sind, beeinflusst direkt die mechanischen Eigenschaften der Struktur, aus der sie bestehen..
Bei Filamenten vom Typ I sind die Helices mittels drei "helikalen Verbindern" miteinander verbunden, die als L1, L12 und L2 bekannt sind und von denen angenommen wird, dass sie der helikalen Domäne Flexibilität verleihen. In Typ II-Filamenten gibt es zusätzlich zwei Subdomänen, die sich zwischen den helikalen Domänen befinden.
Beispiel einer Struktur mit α-Keratinen: Haare
Wenn die Struktur eines typischen Haares analysiert wird, hat es einen Durchmesser von ungefähr 20 Mikrometern und besteht aus toten Zellen, die gepackte Makrofibrillen enthalten, die parallel (nebeneinander) ausgerichtet sind..

Makrofibrillen bestehen aus Mikrofibrillen, die einen kleineren Durchmesser haben und über eine amorphe Proteinsubstanz mit hohem Schwefelgehalt miteinander verbunden sind..
Diese Mikrofibrillen sind Gruppen kleinerer Protofibrillen mit einem 9 + 2-Organisationsmuster, was bedeutet, dass neun Protofibrillen zwei zentrale Protofibrillen umgeben; Alle diese Strukturen bestehen im wesentlichen aus α-Keratin.
Weiche Keratine und harte Keratine
Je nach Schwefelgehalt können α-Keratine als weiche Keratine oder harte Keratine klassifiziert werden. Dies hat mit der mechanischen Widerstandskraft zu tun, die durch die Disulfidbindungen in der Proteinstruktur ausgeübt wird..
Die Gruppe der harten Keratine umfasst diejenigen, die Teil der Haare, Hörner und Nägel sind, während weiche Keratine durch die Filamente in der Haut und den Körnern dargestellt werden..
Disulfidbindungen können durch Aufbringen eines Reduktionsmittels entfernt werden, so dass die aus Keratin bestehenden Strukturen für Tiere nicht leicht verdaulich sind, es sei denn, sie haben einen an Mercaptanen reichen Darm, wie dies bei einigen Insekten der Fall ist..
β-Keratine
Β-Keratine sind viel stärker als α-Keratine und kommen in Reptilien und Vögeln als Teil von Krallen, Schuppen, Federn und Schnäbeln vor. Bei Geckos bestehen auch die an ihren Beinen gefundenen Mikrovilli (Pilze) aus diesem Protein..
Seine Molekülstruktur besteht aus β-gefalteten Schichten, die durch antiparallele Polypeptidketten gebildet werden, die durch Bindungen oder Wasserstoffbrücken miteinander verbunden sind. Diese Ketten bilden nebeneinander kleine starre und flache Oberflächen, die leicht gefaltet sind.
Wo befindet es sich und welche Funktionen hat es??
Die Funktionen von Keratin hängen vor allem mit der Art der Struktur zusammen, die es aufbaut, und mit der Stelle im Körper des Tieres, an der es gefunden wird.
Wie andere faserige Proteine verleiht es den Zellen Stabilität und strukturelle Steifheit, da es zur großen Familie von Proteinen gehört, die als Familie der Zwischenfilamente bekannt sind und Proteine des Zytoskeletts sind..
In Schutz und Deckung
Die obere Hautschicht höherer Tiere weist ein großes Netzwerk von Zwischenfilamenten auf, die durch Keratin gebildet werden. Diese Schicht wird als Epidermis bezeichnet und ist beim Menschen zwischen 30 Mikrometer und 1 nm dick..
Die Epidermis fungiert als Schutzbarriere gegen verschiedene Arten von mechanischem und chemischem Stress und wird von einem speziellen Zelltyp synthetisiert, der als "Keratinozyten" bezeichnet wird..
Neben der Epidermis gibt es eine noch größere äußere Schicht, die sich ständig ablöst und als Stratum Corneum bekannt ist, das ähnliche Funktionen erfüllt..
Dornen und Federkiele werden auch von verschiedenen Tieren zu ihrem eigenen Schutz vor Raubtieren und anderen Angreifern verwendet..
Die "Rüstung" der Pangoline, kleine insektenfressende Säugetiere, die in Asien und Afrika leben, besteht ebenfalls aus "Keratinschuppen", die sie schützen..
In der Verteidigung und anderen Funktionen
Die Hörner werden bei Tieren der Familie der Bovidae, dh bei Kühen, Schafen und Ziegen, beobachtet. Sie sind sehr starke und widerstandsfähige Strukturen, und die Tiere, die sie haben, verwenden sie als Organe der Verteidigung und der Werbung..
Die Hörner werden von einem knöchernen Zentrum aus „schwammigem“ Knochen gebildet, das von Haut bedeckt ist, die aus dem hinteren Bereich des Schädels herausragt..

Krallen und Nägel dienen neben ihrer Funktion beim Füttern und Zurückhalten auch als "Waffen" zur Verteidigung gegen Angreifer und Raubtiere..
Die Schnäbel von Vögeln dienen mehreren Zwecken, darunter Nahrung, Verteidigung, Werbung, Wärmeaustausch und Pflege. In der Natur gibt es bei Vögeln mehrere Arten von Schnäbeln, insbesondere in Bezug auf Form, Farbe, Größe und Stärke der zugehörigen Kiefer..
Die Schnäbel bestehen wie die Hörner aus einem knöchernen Zentrum, das aus dem Schädel herausragt und mit starken Schichten aus β-Keratin bedeckt ist..
Die Zähne von Nicht-Kiefer-Tieren ("angestammte" Wirbeltiere) bestehen aus Keratin und haben wie die Zähne von "höheren" Wirbeltieren mehrere Funktionen bei der Fütterung und Abwehr..
Unterwegs
Die Hufe vieler Wiederkäuer und Huftiere (Pferde, Esel, Elche usw.) bestehen aus Keratin, sind sehr widerstandsfähig und sollen die Beine schützen und die Bewegung unterstützen.
Federn, die auch von Vögeln verwendet werden, um sich zu bewegen, bestehen aus β-Keratin. Diese Strukturen haben auch Funktionen in den Bereichen Tarnung, Werbung, Wärmedämmung und Abdichtung..

In der Industrie
Die Textilindustrie ist anthropozentrisch gesehen einer der Hauptnutzer keratinisierter Strukturen. Die Wolle und Haare vieler Tiere sind auf industrieller Ebene wichtig, da mit ihnen verschiedene Kleidungsstücke hergestellt werden, die für Menschen aus verschiedenen Blickwinkeln nützlich sind.
Verweise
- Koolman, J. & Roehm, K. (2005). Farbatlas der Biochemie (2. Aufl.). New York, USA: Thieme.
- C. Mathews, K. van Holde & K. Ahern (2000). Biochemie (3. Aufl.). San Francisco, Kalifornien: Pearson.
- Nelson, D. L. & Cox, M. M. (2009). Lehninger Prinzipien der Biochemie. Omega-Ausgaben (5. Aufl.).
- Pauling, L. & Corey, R. (1951). Die Struktur von Haaren, Muskeln und verwandten Proteinen. Chemie, 37, 261-271.
- Phillips, D., Korge, B. & James, W. (1994). Keratin und Keratinisierung. Zeitschrift der American Academy of Dermatology, 30(1), 85-102.
- Rouse, J. G. & Dyke, M. E. Van. (2010). Ein Überblick über keratinbasierte Biomaterialien für biomedizinische Anwendungen. Materialien, 3, 999-1014.
- Smith, F.J.D. (2003). Die molekulare Genetik von Keratinstörungen. Am J Clin Dermatol, 4(5), 347 & ndash; 364.
- Voet, D. & Voet, J. (2006). Biochemie (3. Aufl.). Panamerican Medical Editorial.
- Wang, B., Yang, W., McKittrick, J. & Meyers, M. A. (2016). Keratin: Struktur, mechanische Eigenschaften, Vorkommen in biologischen Organismen und Bemühungen um Bioinspiration. Fortschritte in der Materialwissenschaft.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.