
Was sind entartete Orbitale?
Das entartete Orbitale Sie sind alle diejenigen, die auf dem gleichen Energieniveau sind. Nach dieser Definition müssen sie dieselbe Hauptquantenzahl haben n. Somit sind die 2s- und 2p-Orbitale entartet, da sie zum Energieniveau 2 gehören. Es ist jedoch bekannt, dass ihre Winkel- und Radialwellenfunktionen unterschiedlich sind.
Wie die Werte von n, Die Elektronen beginnen andere Energieebenen wie die d- und f-Orbitale zu besetzen. Jedes dieser Orbitale hat seine eigenen Eigenschaften, die auf den ersten Blick in ihren eckigen Formen erkennbar sind. Dies sind die kugelförmigen, hantelförmigen (p), kleeblatt- (d) und kugelförmigen (f) Figuren.
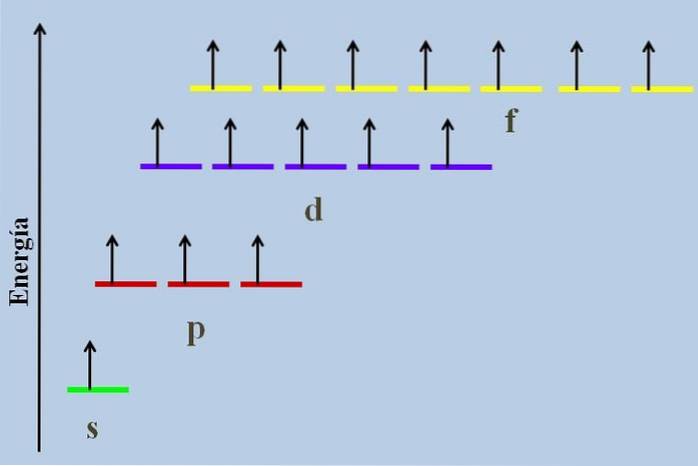
Zwischen ihnen gibt es einen energetischen Unterschied, obwohl sie zur selben Ebene gehören n.
Das obige Bild zeigt beispielsweise ein Energieschema mit Orbitalen, die von ungepaarten Elektronen besetzt sind (ein abnormaler Fall). Es ist ersichtlich, dass von allen stabilsten (dem mit der niedrigsten Energie) das ns-Orbital (1s, 2s, ...) ist, während das nf das instabilste ist (das mit der höchsten Energie)..
Artikelverzeichnis
- 1 Entartete Orbitale eines isolierten Atoms
- 1.1 Orbitale p
- 1.2 Orbitale d
- 1.3 Orbitale f
- 2 Entartete Hybridorbitale
- 3 Referenzen
Entartete Orbitale eines isolierten Atoms
Entartete Orbitale mit dem gleichen Wert von n, Sie befinden sich in einem Energieschema auf derselben Linie. Aus diesem Grund befinden sich die drei roten Streifen, die die p-Orbitale symbolisieren, auf derselben Linie. ebenso wie die lila und gelben Streifen auf die gleiche Weise.
Das Diagramm im Bild verstößt gegen die Hundsche Regel: Die Orbitale mit höherer Energie werden mit Elektronen gefüllt, ohne sie zuerst mit den Orbitalen mit niedrigerer Energie zu paaren. Wenn sich die Elektronen paaren, verliert das Orbital Energie und übt eine größere elektrostatische Abstoßung auf die ungepaarten Elektronen der anderen Orbitale aus..
Solche Effekte werden jedoch in vielen Energiediagrammen nicht berücksichtigt. Wenn ja, und Hunds Regel zu befolgen, ohne die d-Orbitale vollständig auszufüllen, würde man sehen, dass sie aufhören, entartet zu sein.
Wie bereits erwähnt, hat jedes Orbital seine eigenen Eigenschaften. Bei einem isolierten Atom mit seiner elektronischen Konfiguration sind die Elektronen in der genauen Anzahl der Orbitale angeordnet, um sie aufzunehmen. Nur diejenigen, deren Energie gleich ist, können als entartet angesehen werden.
Orbitale p
Die drei roten Streifen für die entarteten p-Orbitale im Bild zeigen an, dass beide px, pY. Und Pz Sie besitzen die gleiche Energie. In jedem befindet sich ein ungepaartes Elektron, das durch vier Quantenzahlen beschrieben wird (n, l, ml Y. Frau), während die ersten drei die Orbitale beschreiben.
Der einzige Unterschied zwischen ihnen wird durch das magnetische Moment bezeichnet ml, das zeichnet den Weg von px auf einer x-Achse, pY. auf der y-Achse und pz auf der z-Achse. Alle drei sind gleich, unterscheiden sich jedoch nur in ihrer räumlichen Ausrichtung. Aus diesem Grund sind sie immer energetisch ausgerichtet, dh entartet.
Da sie gleich sind, ein isoliertes Stickstoffatom (mit 1s Konfigurationzwei2szwei2 P.3) muss seine drei p-Orbitale entartet halten. Das Energieszenario ändert sich jedoch abrupt, wenn man ein N-Atom innerhalb eines Moleküls oder einer chemischen Verbindung betrachtet..
Warum? Denn obwohl px, pY. Und Pz Ihre Energie ist gleich, dies kann in jedem von ihnen variieren, wenn sie unterschiedliche chemische Umgebungen haben. das heißt, wenn sie an verschiedene Atome binden.
Orbitale d
Es gibt fünf lila Streifen, die die d-Orbitale bezeichnen. In einem isolierten Atom gelten diese fünf Orbitale als entartet, selbst wenn sie Elektronen gepaart haben. Im Gegensatz zu den p-Orbitalen gibt es diesmal jedoch einen deutlichen Unterschied in ihren Winkelformen.
Daher bewegen sich seine Elektronen im Raum in Richtungen, die von einem d-Orbital zum anderen variieren. Dies führt laut Kristallfeldtheorie, dass eine minimale Störung a verursacht Energiespaltung der Orbitale; Das heißt, die fünf lila Streifen trennen sich und lassen eine Energielücke zwischen ihnen:
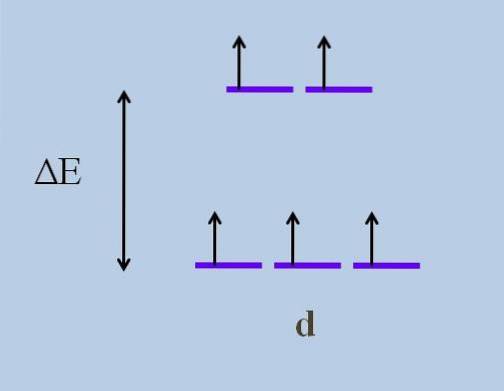
Was sind die oberen Orbitale und was sind die unteren Orbitale? Die oben genannten sind symbolisiert als undG, und die unten t2 g. Beachten Sie, wie anfangs alle violetten Streifen ausgerichtet waren und nun ein Satz von zwei Orbitalen gebildet wurde undG energischer als der andere Satz von drei Orbitalen t2 g.
Diese Theorie erlaubt es uns, die d-d-Übergänge zu erklären, denen viele der in den Verbindungen der Übergangsmetalle (Cr, Mn, Fe usw.) beobachteten Farben zugeschrieben werden. Und was ist die Ursache für diese elektronische Störung? Zur Koordination werden Wechselwirkungen des Metallzentrums mit anderen Molekülen genannt Liganden.
Orbitale f
Und mit den Orbitalen, den gelben Filzstreifen, wird die Situation noch komplizierter. Ihre räumlichen Richtungen variieren stark zwischen ihnen und die Anzeige ihrer Verknüpfungen wird zu komplex.
Tatsächlich werden die f-Orbitale als so intern ummantelt angesehen, dass sie nicht „nennenswert“ an der Bindungsbildung beteiligt sind..
Wenn sich das isolierte Atom mit f-Orbitalen mit anderen Atomen umgibt, beginnen Wechselwirkungen und es kommt zu einer Entfaltung (Verlust der Entartung):
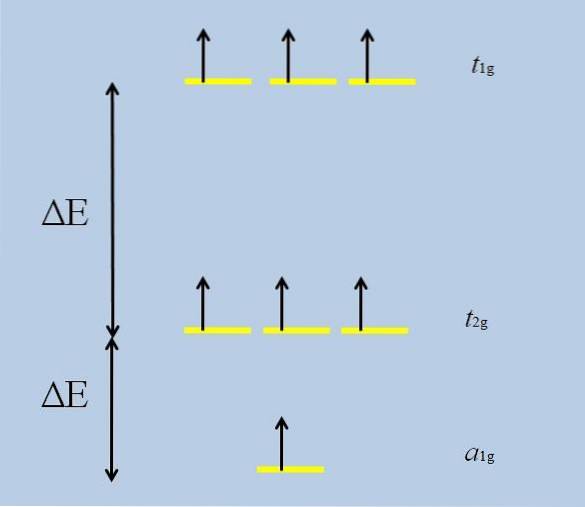
Beachten Sie, dass die gelben Streifen jetzt drei Sätze bilden: t1g, t2 g Y. zu1g, und dass sie nicht mehr entartet sind.
Entartete Hybridorbitale
Es wurde gesehen, dass sich die Orbitale entfalten und die Degeneration verlieren können. Während dies elektronische Übergänge erklärt, verblasst es bei der Aufklärung, wie und warum es unterschiedliche Molekülgeometrien gibt. Hier kommen Hybridorbitale ins Spiel..
Was sind seine Hauptmerkmale? Dass sie entartet sind. Sie entstehen also aus der Mischung von Zeichen der Orbitale s, p, d und f, um entartete Hybride hervorzubringen.
Zum Beispiel mischen sich drei p-Orbitale mit einem s, um vier sp-Orbitale zu ergeben3. Alle sp-Orbitale3 sind entartet und haben daher die gleiche Energie.
Wenn zusätzlich zwei d-Orbitale mit den vier sp gemischt werden3, Sie erhalten sechs sp-Orbitale3dzwei.
Und wie erklären sie molekulare Geometrien? Da es sechs mit gleichen Energien gibt, müssen sie daher symmetrisch im Raum ausgerichtet sein, um gleiche chemische Umgebungen zu erzeugen (zum Beispiel in einer MF-Verbindung6).
Wenn sie dies tun, wird ein Koordinationsoktaeder gebildet, das einer oktaedrischen Geometrie um ein Zentrum (M) entspricht..
Geometrien sind jedoch häufig verzerrt, was bedeutet, dass selbst Hybridorbitale nicht wirklich vollständig entartet sind. Zusammenfassend lässt sich sagen, dass entartete Orbitale nur in isolierten Atomen oder in hochsymmetrischen Umgebungen existieren..
Verweise
- Chemicool Wörterbuch. (2017). Definition von entartet. Wiederhergestellt von: chemicool.com
- SparkNotes LLC. (2018). Atome und Atomorbitale. Wiederhergestellt von: sparknotes.com
- Reine Chemie. (s.f.). Elektronische Konfiguration. Wiederhergestellt von: es-puraquimica.weebly.com
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). CENGAGE Lernen.
- Moreno R. Esparza. (2009). Koordinationschemiekurs: Felder und Orbitale. [PDF]. Wiederhergestellt von: depa.fquim.unam.mx
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.