
Was sind zweiatomige Elemente? (Beispiele)
Das zweiatomige Elemente, Sie werden auch als homonukleare zweiatomige Moleküle bezeichnet und bestehen aus nur zwei Atomen derselben chemischen Elemente. Einige Elemente können nicht alleine existieren, selbst wenn sie von einem anderen Atomtyp isoliert sind.
Elemente dieser Art verbinden sich mit Atomen desselben Elements, um stabil zu sein. Mit anderen Worten, Wasserstoff, ein zweiatomiges Element, kann nicht allein sein. Es kann nicht einfach existieren H..
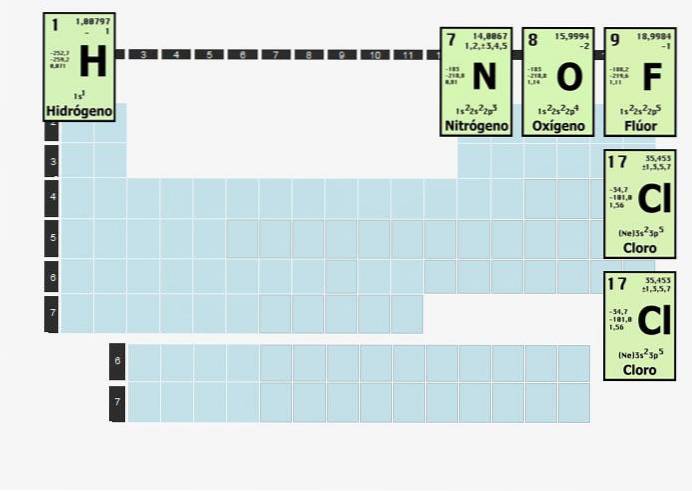
Wasserstoff ist so reaktiv, dass er sich, wenn er von allem außer Wasserstoff isoliert wird, zu einem zweiatomigen Molekül (zwei Atome) verbindet. Daher existiert Wasserstoffgas, das manchmal als Brennstoff verwendet wird, als H.zwei.
Diatomeenmoleküle
Diatomeenmoleküle enthalten zwei Atome, die chemisch gebunden sind. Wenn die beiden Atome identisch sind, wie das Sauerstoffmolekül (O.zwei) bildet ein homonukleares zweiatomiges Molekül, während es, wenn die Atome unterschiedlich sind, wie im Kohlenmonoxid (CO) -Molekül, ein heteronukleares zweiatomiges Molekül bildet.
Moleküle, die mehr als zwei Atome enthalten, werden als mehratomige Moleküle bezeichnet, beispielsweise Kohlendioxid (CO)zwei) und Wasser (H.zweiODER). Polymermoleküle können viele tausend Komponentenatome enthalten.
Es gibt sieben Elemente, aus denen zweiatomige Moleküle bestehen. Die folgenden 5-Element-Gase werden bei Raumtemperatur und -druck als zweiatomige Moleküle gefunden:
-Wasserstoff - H.zwei
-Stickstoff - N.zwei
-Sauerstoff - O.zwei
-Fluorid - F.zwei
-Chlor - Clzwei
Brom und Iod liegen üblicherweise in flüssiger Form vor, aber auch als zweiatomige Gase bei etwas höheren Temperaturen, wodurch insgesamt 7 zweiatomige Elemente entstehen..
-Brom - Brzwei
-Jod - ichzwei
Diatomare Elemente sind Halogene (Fluor, Chlor, Brom, Jod) und Elemente mit einem -gen-Ende (Wasserstoff, Sauerstoff, Stickstoff). Astatin ist ein weiteres Halogen, dessen Verhalten jedoch unbekannt ist..
Eigenschaften von zweiatomigen Elementen
Alle zweiatomigen Moleküle sind linear, was die einfachste räumliche Anordnung von Atomen darstellt.
Es ist zweckmäßig und üblich, ein zweiatomiges Molekül als zwei Punktmassen (die zwei Atome) darzustellen, die durch eine masselose Feder verbunden sind..
Die an den Bewegungen des Moleküls beteiligten Energien können in drei Kategorien unterteilt werden:
- Die Translationsenergien (das Molekül, das sich von Punkt A nach Punkt B bewegt)
- Rotationsenergien (das Molekül dreht sich um seine Achse)
- Schwingungsenergien (Moleküle, die auf verschiedene Weise schwingen)
Alle zweiatomigen Elemente sind Gase bei Raumtemperatur mit Ausnahme von Brom und Jod, die flüssig sind (Jod kann sogar im festen Zustand vorliegen), und alle mit Ausnahme von Sauerstoff und Stickstoff sind durch eine Einfachbindung verbunden..
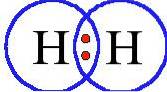
Das Sauerstoffmolekül hat zwei Atome, die durch eine Doppelbindung und das Stickstoffmolekül durch eine Dreifachbindung verbunden sind.
Einige zweiatomige Elemente
Wasserstoff
Wasserstoff (H.zwei) mit einer Ordnungszahl von 1 ist ein farbloses Gas, das von Henry Cavendish erst 1766 offiziell als Element entdeckt wurde, aber etwa hundert Jahre zuvor von Robert Boyle versehentlich gefunden wurde.
Es ist ein farbloses, geruchloses, ungiftiges Gas, das natürlich in unserem Universum vorkommt. Als erstes Element im Periodensystem ist Wasserstoff das leichteste und am häufigsten vorkommende aller chemischen Elemente im Universum, da er 75% seiner Masse ausmacht..
Stickstoff
Stickstoff (N.zwei) hat eine Ordnungszahl von sieben und macht etwa 78,05 Vol .-% der Erdatmosphäre aus.
Es ist ein geruchloses, farbloses und meist inertes Gas, und es bleibt in flüssigem Zustand farblos und geruchlos..

Sauerstoff
Sauerstoff (O.zwei) hat eine Ordnungszahl von acht. Dieses farblose, geruchlose Gas hat acht Protonen im Kern und ist im flüssigen und festen Zustand hellblau..
Ein Fünftel der Erdatmosphäre besteht aus Sauerstoff und ist nach Masse das dritthäufigste Element im Universum..
Sauerstoff ist das massereichste Element in der Biosphäre der Erde. Die hohe Sauerstoffkonzentration in der Atmosphäre ist das Ergebnis des Sauerstoffkreislaufs der Erde, der hauptsächlich durch die Photosynthese in Pflanzen angetrieben wird..
Fluor
Fluor (F.zwei) hat eine Ordnungszahl von neun und ist das reaktivste und elektronegativste aller Elemente. Dieses nichtmetallische Element ist ein hellgelbes Gas, das zur Halogengruppe gehört.
George Gore war anscheinend der erste Wissenschaftler, der Fluor isolierte, aber sein Experiment explodierte, als das erzeugte Fluor mit Wasserstoff reagierte..
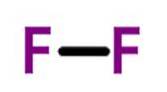
1906 erhielt Ferdinand Frederic Henri Moissan für seine Arbeiten zur Isolierung von Fluor im Jahr 1886 den Nobelpreis für Chemie. Es ist das elektronegativste Element im Periodensystem..
Chlor
Chlor (Clzwei) ist ein Mitglied der Halogengruppe mit einer Ordnungszahl von siebzehn. Eine seiner Formen, NaCl, wird seit der Antike verwendet.

Chlor wird seit Tausenden von Jahren in vielen anderen Formen verwendet, wurde jedoch erst 1810 von Sir Humphry Davy benannt..
Chlor in seiner reinen Form ist gelblichgrün, aber seine üblichen Verbindungen sind typischerweise farblos..
Brom
Brom (Brzwei) hat eine Ordnungszahl von fünfunddreißig. Es ist eine schwere dunkelbraune Flüssigkeit, das einzige nichtmetallische Element, das eine Flüssigkeit ist.

Brom wurde 1826 von Antoine J. Balard entdeckt. Es wurde für wichtige Zwecke verwendet, lange bevor es offiziell entdeckt wurde..
Jod
Jod (ichzwei) hat eine Ordnungszahl von dreiundfünfzig, mit dreiundfünfzig Protonen im Kern eines Atoms. Es ist ein blauschwarzes Nichtmetall, das in der organischen Chemie eine sehr wichtige Rolle spielt..
Jod wurde 1811 von Barnard Courtois entdeckt. Er nannte es Jod vom griechischen Wort "Jod", was violett bedeutet. Es ist ein festes Blauschwarz.
Jod spielt eine sehr wichtige Rolle in der Biologie aller lebenden Organismen, da sein Mangel zu Krankheiten wie Hyperthyreose und Hypothyreose führt.
Verweise
- (S.F.). Homonukleare zweiatomige Moleküle. Von boundless.com wiederhergestellt.
- Chlor Fakten. (S.F.). Von softschools.com wiederhergestellt.
- Diatomeenelemente. (S.F.). Von ths.talawanda.org wiederhergestellt.
- Encyclopædia Britannica. (2016, 14. September). Molekül. Von britannica.com wiederhergestellt.
- Helmenstine, A. (2014, 28. September). Diatomeenelemente. Von sciencenotes.org wiederhergestellt.
- Helmenstine, A. M. (2017, 29. März). Was sind die sieben zweiatomigen Elemente?? Von gedankenco.com wiederhergestellt.
- Sauerstoff Fakten. (S.F.). Von softschools.com wiederhergestellt.
- Royal Society of Chemistry. (2015). molekulares Jod. Von chemspider.com wiederhergestellt.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.