
Was sind Dipol-Dipol-Kräfte?
Das Dipol-Dipol-Kräfte oder Keesom-Kräfte sind jene intermolekularen Wechselwirkungen, die in Molekülen mit permanenten Dipolmomenten vorhanden sind. Es ist eine der Van-der-Waals-Kräfte und obwohl es bei weitem nicht die stärkste ist, ist es ein Schlüsselfaktor, der die physikalischen Eigenschaften vieler Verbindungen erklärt..
Der Begriff "Dipol" bezieht sich ausdrücklich auf zwei Pole: einen negativen und einen positiven. Wir sprechen also von dipolaren Molekülen, wenn sie Bereiche mit hoher und niedriger Elektronendichte definiert haben, was nur möglich ist, wenn die Elektronen bevorzugt zu bestimmten Atomen "wandern": den elektronegativsten..
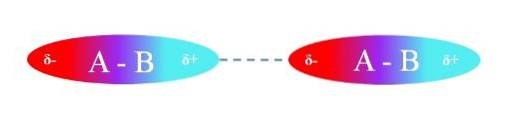
Das obere Bild zeigt die Dipol-Dipol-Wechselwirkungen zwischen zwei A-B-Molekülen mit permanenten Dipolmomenten. Ebenso kann beobachtet werden, wie die Moleküle so ausgerichtet sind, dass die Wechselwirkungen effizient sind. Somit zieht der positive Bereich δ + den negativen Bereich δ an-.
Demnach kann spezifiziert werden, dass diese Arten von Wechselwirkungen gerichtet sind (im Gegensatz zu ionischen Ladungs-Ladungs-Wechselwirkungen). Die Moleküle in ihrer Umgebung richten ihre Pole so aus, dass die Summe all dieser Wechselwirkungen der Verbindung eine große intermolekulare Stabilität verleiht, obwohl sie schwach sind..
Dies führt dazu, dass Verbindungen (organisch oder anorganisch), die Dipol-Dipol-Wechselwirkungen bilden können, hohe Siede- oder Schmelzpunkte aufweisen..
Artikelverzeichnis
- 1 Dipolmoment
- 1.1 Symmetrie
- 1.2 Asymmetrie in nichtlinearen Molekülen
- 2 Orientierungen der Dipole
- 3 Wechselwirkungen durch Wasserstoffbrücken
- 4 Referenzen
Dipolmoment
Das Dipolmoment µ eines Moleküls ist eine Vektorgröße. Mit anderen Worten: Es hängt von den Richtungen ab, in denen ein Polaritätsgradient vorliegt. Wie und warum entsteht dieser Gradient? Die Antwort liegt in den Bindungen und in der Eigenart der Atome der Elemente..
Zum Beispiel ist im oberen Bild A elektronegativer als B, so dass in der A-B-Bindung die höchste Elektronendichte um A liegt.
Andererseits "gibt" B seine Elektronenwolke auf und ist daher von einem elektronenarmen Bereich umgeben. Dieser Unterschied in den Elektronegativitäten zwischen A und B erzeugt den Polaritätsgradienten.
Da eine Region reich an Elektronen (δ-) ist, während die andere arm an Elektronen (δ +) ist, erscheinen die beiden Pole, die in Abhängigkeit von den Abständen zwischen ihnen unterschiedliche Größen von µ erzeugen, die für jede Verbindung bestimmt werden.
Symmetrie
Wenn ein Molekül einer bestimmten Verbindung µ = 0 hat, spricht man von einem unpolaren Molekül (auch wenn es Polaritätsgradienten aufweist)..
Um zu verstehen, wie Symmetrie - und damit Molekülgeometrie - bei diesem Parameter eine wichtige Rolle spielt, muss die A-B-Bindung erneut betrachtet werden..
Aufgrund der unterschiedlichen Elektronegativitäten gibt es definierte Regionen, die reich an Elektronen und arm sind.
Was wäre, wenn die Links A-A oder B-B wären? In diesen Molekülen würde es kein Dipolmoment geben, da beide Atome auf die gleiche Weise die Elektronen der Bindung zu sich ziehen (hundertprozentige kovalente Bindung).
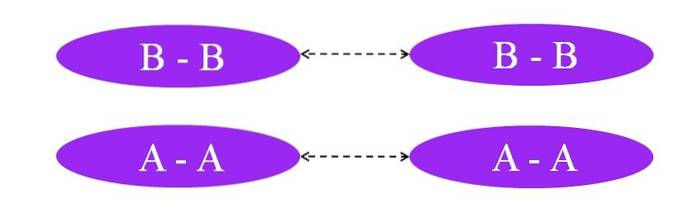
Wie auf dem Bild zu sehen ist, gibt es weder in Molekül A-A noch in Molekül B-B Regionen, die reich an Elektronen sind oder arm (rot und blau). Hier ist eine andere Art von Kraft für das Zusammenhalten von A verantwortlichzwei und Bzwei: induzierte Dipol-Dipol-Wechselwirkungen, auch als Londoner Kräfte oder Streukräfte bekannt.
Im Gegenteil, wenn die Moleküle vom Typ AOA oder BOB wären, würde es Abstoßungen zwischen ihren Polen geben, weil sie gleiche Ladungen haben:
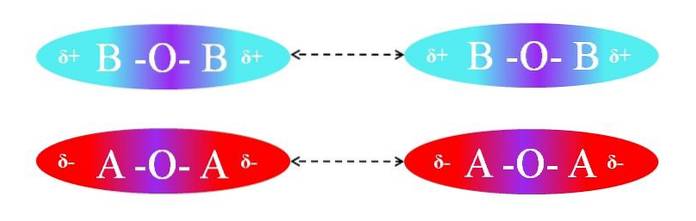
Die δ + -Regionen von zwei BOB-Molekülen erlauben keine effiziente Dipol-Dipol-Wechselwirkung; Gleiches gilt für die δ-Regionen der beiden AOA-Moleküle. Ebenso haben beide Molekülpaare µ = 0. Der O-A-Polaritätsgradient wird mit dem der A-O-Bindung vektoriell aufgehoben.
Infolgedessen spielen auch Dispersionskräfte im AOA- und BOB-Paar eine Rolle, da keine effektive Orientierung der Dipole vorliegt.
Asymmetrie in nichtlinearen Molekülen
Der einfachste Fall ist der des CF-Moleküls4 (oder geben Sie CX ein4). Hier hat C eine tetraedrische Molekülgeometrie und elektronenreiche Regionen befinden sich an den Eckpunkten, insbesondere an den elektronegativen Atomen von F..
Der Polaritätsgradient C-F hebt sich in eine der Richtungen des Tetraeders auf, wodurch die Vektorsumme aller dieser Werte gleich 0 wird.
Obwohl das Zentrum des Tetraeders sehr positiv (δ +) und seine Eckpunkte sehr negativ (δ-) sind, kann dieses Molekül keine Dipol-Dipol-Wechselwirkungen mit anderen Molekülen bilden..
Orientierungen der Dipole
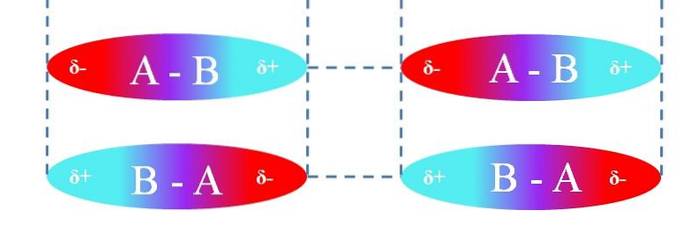
Bei linearen A-B-Molekülen sind sie so ausgerichtet, dass sie die effizientesten Dipol-Dipol-Wechselwirkungen bilden (wie im obigen Bild zu sehen). Das Obige gilt in gleicher Weise für andere Molekülgeometrien; Zum Beispiel die eckigen bei NO-Molekülenzwei.
Somit bestimmen diese Wechselwirkungen, ob Verbindung A-B bei Raumtemperatur ein Gas, eine Flüssigkeit oder ein Feststoff ist..
Im Fall der Verbindungen A.zwei und Bzwei (die der lila Ellipsen) ist es sehr wahrscheinlich, dass sie gasförmig sind. Wenn seine Atome jedoch sehr sperrig und leicht polarisierbar sind (was die Londoner Kräfte erhöht), können beide Verbindungen entweder fest oder flüssig sein..
Je stärker die Dipol-Dipol-Wechselwirkungen sind, desto größer ist die Kohäsion zwischen den Molekülen. Ebenso ist der Schmelz- und Siedepunkt der Verbindung umso höher. Dies liegt daran, dass höhere Temperaturen erforderlich sind, um diese Wechselwirkungen zu "brechen"..
Andererseits führt ein Temperaturanstieg dazu, dass die Moleküle häufiger vibrieren, sich drehen und bewegen. Diese "molekulare Bewegung" beeinträchtigt die Orientierung der Dipole und daher werden die intermolekularen Kräfte der Verbindung geschwächt..
Wasserstoffbrückenbindungen
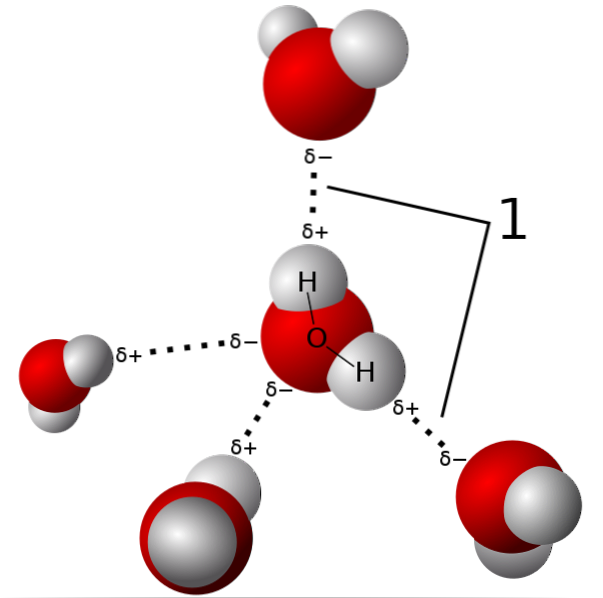
Im obigen Bild sind fünf Wassermoleküle gezeigt, die durch Wasserstoffbrückenbindungen interagieren. Dies ist eine spezielle Art von Dipol-Dipol-Wechselwirkungen. Die elektronenarme Region wird von H besetzt; und die elektronenreiche Region (δ-) wird von den hochelektronegativen Atomen N, O und F besetzt.
Das heißt, Moleküle mit N-, O- und F-Atomen, die an H gebunden sind, können Wasserstoffbrückenbindungen bilden..
Somit sind Wasserstoffbrückenbindungen O-H-O, N-H-N und F-H-F, O-H-N, N-H-O usw. Diese Moleküle haben permanente und sehr intensive Dipolmomente, die sie richtig ausrichten, um diese Brücken "auszunutzen"..
Sie sind energetisch schwächer als jede kovalente oder ionische Bindung. Die Summe aller Wasserstoffbrückenbindungen in der Phase einer Verbindung (fest, flüssig oder gasförmig) führt jedoch dazu, dass sie Eigenschaften aufweist, die sie als einzigartig definieren..
Dies ist beispielsweise der Fall bei Wasser, dessen Wasserstoffbrückenbindungen für seinen hohen Siedepunkt verantwortlich sind und im Eiszustand weniger dicht sind als flüssiges Wasser; Grund, warum Eisberge in Meeren schwimmen.
Verweise
- Dipol-Dipol-Kräfte. Abgerufen am 30. Mai 2018 von: chem.purdue.edu
- Grenzenloses Lernen. Dipol-Dipol-Kraft. Abgerufen am 30. Mai 2018 von: classes.lumenlearning.com
- Jennifer Roushar. (2016). Dipol-Dipol-Kräfte. Abgerufen am 30. Mai 2018 von: sophia.org
- Helmenstine, Anne Marie, Ph.D. (03. Mai 2018). Was sind Beispiele für Wasserstoffbrücken?? Abgerufen am 30. Mai 2018 von :oughtco.com
- Mathews, C.K., Van Holde, K.E. und Ahern, K.G. (2002) Biochemistry. Dritte Edition. Addison Wesley Longman, Inc., S. 33.
- Whitten, Davis, Peck & Stanley. Chemie. (8. Aufl.). CENGAGE Learning, S. 450-452.
- Benutzer Qwerter. (16. April 2011). 3D-Modell Wasserstoffbrücken in der Toilette. [Zahl]. Abgerufen am 30. Mai 2018 von: commons.wikimedia.org



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.