
Was sind wässrige Lösungen? (Mit Beispielen)
Das wässrige Lösungen sind solche Lösungen, die Wasser verwenden, um eine Substanz zu zersetzen. Zum Beispiel Schlamm oder Zuckerwasser. Wenn sich eine chemische Spezies in Wasser gelöst hat, wird dies durch das Schreiben (aq) nach dem chemischen Namen bezeichnet.
Hydrophile (wasserliebende) Substanzen und viele ionische Verbindungen lösen sich oder dissoziieren in Wasser. Wenn sich beispielsweise Tafelsalz oder Natriumchlorid in Wasser lösen, dissoziiert es in seine Ionen unter Bildung von Na + (aq) und Cl- (aq)..

Hydrophobe (wasserängstliche) Substanzen lösen sich im Allgemeinen nicht in Wasser und bilden keine wässrigen Lösungen. Zum Beispiel führt das Mischen von Öl und Wasser nicht zur Auflösung oder Dissoziation.
Viele organische Verbindungen sind hydrophob. Nichtelektrolyte können sich in Wasser lösen, aber sie dissoziieren nicht in Ionen und behalten ihre Integrität als Moleküle bei. Beispiele für Nichtelektrolyte umfassen Zucker, Glycerin, Harnstoff und Methylsulfonylmethan (MSM).
Eigenschaften wässriger Lösungen
Wässrige Lösungen leiten oft Strom. Lösungen, die starke Elektrolyte enthalten, sind in der Regel gute elektrische Leiter (z. B. Meerwasser), während Lösungen mit schwachen Elektrolyten in der Regel schlechte Leiter sind (z. B. Leitungswasser)..
Der Grund ist, dass starke Elektrolyte vollständig in Ionen in Wasser dissoziieren, während schwache Elektrolyte unvollständig dissoziieren..
Wenn chemische Reaktionen zwischen Spezies in einer wässrigen Lösung auftreten, handelt es sich normalerweise um Doppelverdrängungsreaktionen (auch Metathese oder Doppelsubstitution genannt)..
Bei dieser Art von Reaktion tritt das Kation in einem Reagenz an die Stelle des Kations im anderen Reagenz und bildet typischerweise eine Ionenbindung. Eine andere Art, darüber nachzudenken, ist, dass reaktive Ionen "Partner wechseln".
Reaktionen in wässriger Lösung können wasserlösliche Produkte oder einen Niederschlag erzeugen..
Ein Niederschlag ist eine Verbindung mit geringer Löslichkeit, die häufig als Feststoff aus der Lösung fällt..
Die Begriffe Säure, Base und pH gelten nur für wässrige Lösungen. Sie können beispielsweise den pH-Wert von Zitronensaft oder Essig (zwei wässrige Lösungen) messen und es handelt sich um schwache Säuren. Aus dem Test von Pflanzenöl mit pH-Papier können Sie jedoch keine aussagekräftigen Informationen erhalten..
Warum lösen sich einige Feststoffe in Wasser??
Der Zucker, den wir zum Süßen von Kaffee oder Tee verwenden, ist ein molekularer Feststoff, in dem einzelne Moleküle durch relativ schwache intermolekulare Kräfte zusammengehalten werden..
Wenn sich Zucker in Wasser löst, werden die schwachen Bindungen zwischen einzelnen Saccharosemolekülen aufgebrochen und diese C12H22O11-Moleküle werden in Lösung freigesetzt..
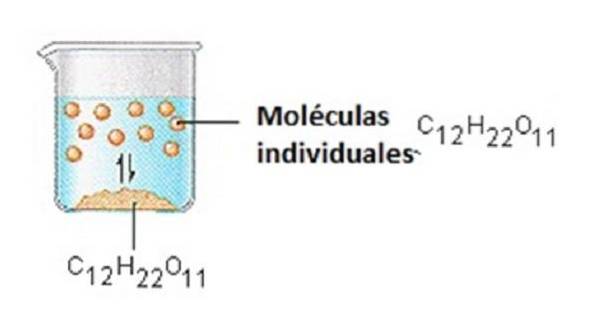
Es braucht Energie, um die Bindungen zwischen den C12H22O11-Molekülen in Saccharose aufzubrechen. Es braucht auch Energie, um die Wasserstoffbrückenbindungen in Wasser aufzubrechen, die aufgebrochen werden müssen, um eines dieser Saccharosemoleküle in Lösung zu bringen..
Zucker löst sich in Wasser auf, weil Energie freigesetzt wird, wenn leicht polare Saccharosemoleküle intermolekulare Bindungen mit polaren Wassermolekülen eingehen..
Die schwachen Bindungen, die sich zwischen dem gelösten Stoff und dem Lösungsmittel bilden, kompensieren die Energie, die erforderlich ist, um die Struktur sowohl des reinen gelösten Stoffs als auch des Lösungsmittels zu verändern..
Bei Zucker und Wasser funktioniert dieser Prozess so gut, dass bis zu 1800 Gramm Saccharose in einem Liter Wasser gelöst werden können..
Ionische Feststoffe (oder Salze) enthalten positive und negative Ionen, die dank der großen Anziehungskraft zwischen Partikeln mit entgegengesetzten Ladungen zusammengehalten werden.
Wenn sich einer dieser Feststoffe in Wasser löst, werden die Ionen, aus denen der Feststoff besteht, in Lösung freigesetzt, wo sie sich mit den polaren Lösungsmittelmolekülen verbinden..
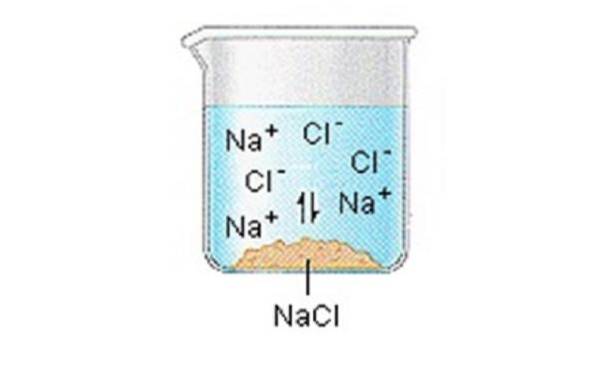
NaCl (s) ”Na + (aq) + Cl- (aq)
Wir können allgemein annehmen, dass Salze in ihren Ionen dissoziieren, wenn sie in Wasser gelöst werden..
Ionische Verbindungen lösen sich in Wasser auf, wenn die Energie, die bei der Wechselwirkung der Ionen mit den Wassermolekülen freigesetzt wird, die Energie überwiegt, die zum Aufbrechen der Ionenbindungen im Feststoff erforderlich ist, und die Energie, die zum Trennen der Wassermoleküle erforderlich ist, damit die Ionen in die Lösung eingeführt werden können.
Löslichkeitsregeln
Abhängig von der Löslichkeit eines gelösten Stoffes gibt es drei mögliche Ergebnisse:
1) Wenn die Lösung weniger gelösten Stoff enthält als die maximale Menge, die sie auflösen kann (ihre Löslichkeit), handelt es sich um eine verdünnte Lösung;
2) Wenn die Menge des gelösten Stoffes genau der Menge seiner Löslichkeit entspricht, ist er gesättigt;
3) Wenn mehr gelöster Stoff vorhanden ist, als sich auflösen kann, trennt sich der überschüssige gelöste Stoff von der Lösung.
Wenn dieser Trennungsprozess eine Kristallisation beinhaltet, bildet er einen Niederschlag. Durch Ausfällung wird die Konzentration des gelösten Stoffes bis zur Sättigung verringert, um die Stabilität der Lösung zu erhöhen..
Das Folgende sind die Löslichkeitsregeln für übliche ionische Feststoffe. Wenn sich zwei Regeln zu widersprechen scheinen, hat die vorhergehende Vorrang.
1- Salze, die Elemente der Gruppe I enthalten (Li+, N / A+, K.+, Cs+, Rb+) sind löslich. Es gibt nur wenige Ausnahmen von dieser Regel. Salze, die das Ammoniumion (NH) enthalten4+) sind auch löslich.
2- Nitrathaltige Salze (NR3-) sind im Allgemeinen löslich.
3- Die Salze, die Cl -, Br - oder I - enthalten, sind im Allgemeinen löslich. Wichtige Ausnahmen von dieser Regel sind die Halogenidsalze von Ag+, Pb2+ und (Hg2)zwei+. Somit ist AgCl, PbBrzwei und HgzweiClzwei sie sind unlöslich.
4- Die meisten Silbersalze sind unlöslich. AgNO3 und Ag (C.zweiH.3ODERzwei) sind übliche lösliche Silbersalze; Praktisch alle anderen sind unlöslich.
5- Die meisten Sulfatsalze sind löslich. Wichtige Ausnahmen von dieser Regel sind CaSO4, Baso4, PbSO4, AgzweiSO4 und SrSO4.
6- Die meisten Hydroxidsalze sind nur schwer löslich. Hydroxidsalze von Elementen der Gruppe I sind löslich. Hydroxidsalze von Elementen der Gruppe II (Ca, Sr und Ba) sind schwer löslich.
Die Hydroxidsalze von Übergangsmetallen und Al3 + sie sind unlöslich. Somit ist Fe (OH)3, Al (OH)3, Co (OH)zwei Sie sind nicht löslich.
7- Die meisten Übergangsmetallsulfide sind in hohem Maße unlöslich, einschließlich CdS, FeS, ZnS und AgzweiS. Arsen, Antimon, Wismut und Bleisulfide sind ebenfalls unlöslich.
8- Carbonate sind häufig unlöslich. Carbonate der Gruppe II (CaCO3, SrCO3 und BaCO3) sind unlöslich, ebenso wie FeCO3 und PbCO3.
9- Chromate sind oft unlöslich. Beispiele sind PbCrO4 und BaCrO4.
10-Phosphate wie Ca.3(PO4)zwei und Ag3PO4 sind häufig unlöslich.
11- Fluoride wie BaFzwei, MgFzwei und PbFzwei sind häufig unlöslich.
Beispiele für die Löslichkeit in wässrigen Lösungen
Cola, Salzwasser, Regen, Säurelösungen, Basenlösungen und Salzlösungen sind Beispiele für wässrige Lösungen. Wenn Sie eine wässrige Lösung haben, können Sie durch Fällungsreaktionen einen Niederschlag induzieren.
Niederschlagsreaktionen werden manchmal als "Doppelverdrängungs" -Reaktionen bezeichnet. Um festzustellen, ob sich beim Mischen wässriger Lösungen zweier Verbindungen ein Niederschlag bildet:
- Notieren Sie alle Ionen in Lösung.
- Kombinieren Sie sie (Kation und Anion), um alle möglichen Niederschläge zu erhalten.
- Verwenden Sie die Löslichkeitsregeln, um zu bestimmen, welche (falls vorhanden) Kombination (en) unlöslich ist (sind) und ausfällt.
Beispiel 1: Was passiert, wenn Ba (NO3)zwei (aq) und NazweiCO3 (aq)?
In Lösung vorhandene Ionen: Bazwei+, NICHT3-, N / A+, CO3zwei-
Mögliche Niederschläge: BaCO3, NaNO3
Löslichkeitsregeln: BaCO3 ist unlöslich (Regel 5), NaNO3 ist löslich (Regel 1).
Vollständige chemische Gleichung:
Bad3)zwei(aq) + NazweiCO3(aq) ”BaCO3(s) + 2NaNO3 (aq)
Netto-Ionengleichung:
Bazwei+(aq) + CO3zwei-(aq) BaCO3 (s)
Beispiel 2: Was passiert, wenn Pb (NO3)zwei (aq) und NH4Ich (aq)?
In Lösung vorhandene Ionen: Pbzwei+, NICHT3-, NH4+, ich-
Mögliche Niederschläge: PbIzwei, NH4NICHT3
Löslichkeitsregeln: PbIzwei ist unlöslich (Regel 3), NH4NICHT3 ist löslich (Regel 1).
Vollständige chemische Gleichung: Pb (NO3)2 (aq) + 2NH4ich(aq) ”PbI2 (s) + 2NH4NICHT3 (aq)
Nettoionengleichung: Pbzwei+(aq) + 2I-(aq) ”PbI2 (s).
Verweise
- Anne Marie Helmenstine. (2017, 10. Mai). Wässrige Definition (wässrige Lösung). Von gedankenco.com wiederhergestellt.
- Anne Marie Helmenstine. (2017, 14. Mai). Wässrige Lösungsdefinition in der Chemie. Von gedankenco.com wiederhergestellt.
- Antoinette Mursa, K. W. (2017, 14. Mai). Löslichkeitsregeln. Von chem.libretexts.org wiederhergestellt.
- Wässrige Lösungen. (S.F.). Von saylordotorg.github.io wiederhergestellt.
- Berkey, M. (2011, 11. November). Wässrige Lösungen: Definition & Beispiele. Von youtube.com wiederhergestellt.
- Reaktionen in wässriger Lösung. (S.F.). Aus Chemie.bd.psu.edu wiederhergestellt.
- Reid, D. (S.F.). Wässrige Lösung: Definition, Reaktion & Beispiel. Von study.com wiederhergestellt.
- Löslichkeit. (S.F.). Wiederhergestellt von chemed.chem.purdue.edu.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.