
Was ist Spektralnotation?
Das Spektralnotation ist die Anordnung von Elektronen in Energieniveaus um den Kern eines Atoms. Nach dem alten Bohr-Atommodell besetzen Elektronen verschiedene Ebenen in Umlaufbahnen um den Kern, von der ersten Schale, die dem Kern K am nächsten liegt, bis zur siebten Schale Q, die am weitesten vom Kern entfernt ist..
In Bezug auf ein verfeinertes quantenmechanisches Modell sind die K-Q-Schalen in eine Reihe von Orbitalen unterteilt, von denen jedes nicht mehr als ein Elektronenpaar einnehmen kann..

Üblicherweise wird die Elektronenkonfiguration verwendet, um die Orbitale eines Atoms in seinem Grundzustand zu beschreiben, aber sie kann auch verwendet werden, um ein Atom darzustellen, das zu einem Kation oder Anion ionisiert wurde, um den Verlust oder Gewinn von Elektronen in ihren jeweiligen Orbitalen zu kompensieren ..
Viele der physikalischen und chemischen Eigenschaften von Elementen können mit ihren einzigartigen elektronischen Konfigurationen korreliert werden. Valenzelektronen, die Elektronen in der äußersten Schale, sind der bestimmende Faktor für die einzigartige Chemie des Elements..
Wenn Elektronen in der äußersten Hülle eines Atoms irgendeine Energie erhalten, bewegen sie sich zu Schichten höherer Energie. Somit wird ein Elektron in der K-Schale auf die L-Schale übertragen, die sich in einem Zustand höherer Energie befindet.
Wenn das Elektron in seinen Grundzustand zurückkehrt, setzt es die Energie frei, die es absorbiert, indem es ein elektromagnetisches Spektrum (Licht) emittiert. Da jedes Atom eine spezifische elektronische Konfiguration hat, hat es auch ein spezifisches Spektrum, das als Absorptions- (oder Emissions-) Spektrum bezeichnet wird..
Aus diesem Grund bezieht sich der Begriff Spektralnotation auf die Elektronenkonfiguration.
So bestimmen Sie die spektrale Notation: Quantenzahlen
Insgesamt vier Quantenzahlen werden verwendet, um die Bewegung und die Flugbahnen jedes Elektrons innerhalb eines Atoms vollständig zu beschreiben..
Die Kombination aller Quantenzahlen aller Elektronen in einem Atom wird durch eine Wellenfunktion beschrieben, die die Schrödinger-Gleichung erfüllt. Jedes Elektron in einem Atom hat einen eindeutigen Satz von Quantenzahlen.
Nach dem Pauli-Ausschlussprinzip können zwei Elektronen nicht dieselbe Kombination von vier Quantenzahlen teilen.
Quantenzahlen sind wichtig, weil sie verwendet werden können, um die Elektronenkonfiguration eines Atoms und den wahrscheinlichen Ort der Elektronen im Atom zu bestimmen..
Quantenzahlen werden auch verwendet, um andere Eigenschaften von Atomen wie Ionisierungsenergie und Atomradius zu bestimmen..
Quantenzahlen bezeichnen bestimmte Schalen, Unterschalen, Orbitale und Spins von Elektronen.
Dies bedeutet, dass sie die Eigenschaften eines Elektrons in einem Atom vollständig beschreiben, dh jede einzelne Lösung der Schrödinger-Gleichung oder der Wellenfunktion von Elektronen in einem Atom beschreiben..
Es gibt insgesamt vier Quantenzahlen: die Hauptquantenzahl (n), die Orbitaldrehimpulsquantenzahl (l), die magnetische Quantenzahl (ml) und die Elektronenspinquantenzahl (ms).
Die Hauptquantenzahl nn beschreibt die Energie eines Elektrons und den wahrscheinlichsten Abstand des Elektrons vom Kern. Mit anderen Worten, es bezieht sich auf die Größe des Orbitals und das Energieniveau, auf dem ein Elektron platziert ist..
Die Anzahl der Unterschalen oder ll beschreibt die Form des Orbitals. Es kann auch verwendet werden, um die Anzahl der Winkelknoten zu bestimmen.
Die magnetische Quantenzahl ml beschreibt die Energieniveaus in einer Unterschale, und ms bezieht sich auf den Spin auf dem Elektron, der nach oben oder unten gerichtet sein kann..
Aufbauprinzip
Aufbau kommt vom deutschen Wort "Aufbauen", was "bauen" bedeutet. Im Wesentlichen bauen wir durch das Schreiben von Elektronenkonfigurationen Elektronenorbitale auf, wenn wir uns von einem Atom zum anderen bewegen..
Während wir die Elektronenkonfiguration eines Atoms schreiben, füllen wir die Orbitale in aufsteigender Reihenfolge der Ordnungszahl aus.
Das Aufbau-Prinzip stammt aus dem Pauli-Ausschlussprinzip, das besagt, dass ein Atom keine zwei Fermionen (z. B. Elektronen) enthält.
Sie können den gleichen Satz von Quantenzahlen haben, so dass sie bei höheren Energieniveaus "stapeln" müssen. Wie sich Elektronen ansammeln, hängt von den Elektronenkonfigurationen ab.
Stabile Atome haben so viele Elektronen wie Protonen im Kern. Elektronen sammeln sich in Quantenorbitalen um den Kern nach vier Grundregeln, die als Aufbau-Prinzip bezeichnet werden..
- Es gibt keine zwei Elektronen im Atom, die die gleichen vier Quantenzahlen n, l, m und s teilen.
- Elektronen besetzen zuerst die Orbitale mit dem niedrigsten Energieniveau.
- Die Elektronen füllen die Orbitale immer mit der gleichen Spinzahl. Wenn die Orbitale voll sind, beginnt es.
- Die Elektronen füllen die Orbitale mit der Summe der Quantenzahlen n und l. Orbitale mit gleichen Werten von (n + l) werden zuerst mit den niedrigeren n-Werten gefüllt.
Die zweite und vierte Regel sind grundsätzlich gleich. Ein Beispiel für Regel vier wären die 2p- und 3s-Orbitale.
Ein 2p-Orbital ist n = 2 und l = 2 und ein 3s-Orbital ist in beiden Fällen n = 3 und l = 1. (N + l) = 4, aber das 2p-Orbital hat die niedrigste Energie oder den niedrigsten n-Wert und Willen Füllen Sie vor der Schicht 3s.
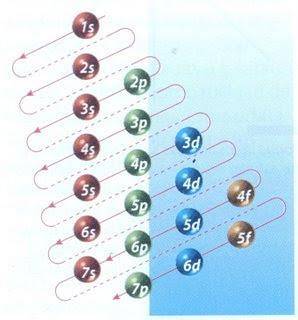
Glücklicherweise kann das in Abbildung 2 gezeigte Moeller-Diagramm zum Füllen von Elektronen verwendet werden. Der Graph wird gelesen, indem die Diagonalen von 1s ausgeführt werden.
Abbildung 2 zeigt die Atomorbitale und die Pfeile folgen dem Weg nach vorne.
Nachdem bekannt ist, dass die Reihenfolge der Orbitale erfüllt ist, müssen Sie sich nur noch die Größe jedes Orbitals merken.
S-Orbitale haben 1 möglichen Wert von ml 2 Elektronen halten
P-Orbitale haben 3 mögliche Werte von ml 6 Elektronen zu halten
D-Orbitale haben 5 mögliche Werte von ml 10 Elektronen zu halten
F-Orbitale haben 7 mögliche Werte von ml 14 Elektronen zu halten
Dies ist alles, was benötigt wird, um die elektronische Konfiguration eines stabilen Atoms eines Elements zu bestimmen..
Nehmen Sie zum Beispiel das Element Stickstoff. Stickstoff hat sieben Protonen und damit sieben Elektronen. Das erste zu füllende Orbital ist das 1s-Orbital. Ein s-Orbital hat zwei Elektronen, so dass noch fünf Elektronen übrig sind.
Das nächste Orbital ist das 2s-Orbital und enthält die nächsten beiden. Die letzten drei Elektronen gehen in das 2p-Orbital, das bis zu sechs Elektronen aufnehmen kann.
Hund Regeln
In Aufbau's Abschnitt wurde diskutiert, wie Elektronen zuerst die Orbitale mit der niedrigsten Energie füllen und sich dann erst dann zu den Orbitalen mit der höchsten Energie bewegen, wenn die Orbitale mit der niedrigsten Energie gefüllt sind..
Es gibt jedoch ein Problem mit dieser Regel. Natürlich müssen die 1s-Orbitale vor den 2s-Orbitalen gefüllt werden, da die 1s-Orbitale einen niedrigeren Wert von n und daher eine niedrigere Energie haben..
Und die drei verschiedenen 2p-Orbitale? In welcher Reihenfolge sollen sie gefüllt werden? Die Antwort auf diese Frage beinhaltet die Hundsche Regel.
Die Hund-Regel besagt:
- Jedes Orbital in einer Unterebene ist einzeln besetzt, bevor ein Orbital doppelt besetzt ist.
- Alle Elektronen in einzeln besetzten Orbitalen haben den gleichen Spin (um den Gesamtspin zu maximieren).
Wenn Elektronen Orbitalen zugeordnet werden, versucht ein Elektron zunächst, alle Orbitale mit ähnlicher Energie (auch als entartete Orbitale bezeichnet) zu füllen, bevor es sich mit einem anderen Elektron in einem halb vollen Orbital paart..
Atome in Grundzuständen neigen dazu, so viele ungepaarte Elektronen wie möglich zu haben. Berücksichtigen Sie bei der Visualisierung dieses Prozesses, wie Elektronen dasselbe Verhalten wie dieselben Pole in einem Magneten zeigen, wenn sie in Kontakt kommen..
Wenn negativ geladene Elektronen die Orbitale füllen, versuchen sie zunächst, sich so weit wie möglich voneinander zu entfernen, bevor sie sich paaren müssen..
Verweise
- Anastasiya Kamenko, T. E. (2017, 24. März). Quantenzahlen. Von chem.libretexts.org wiederhergestellt.
- Aufbauprinzip. (2015, 3. Juni). Von chem.libretexts.org wiederhergestellt.
- Elektronenkonfigurationen und die Eigenschaften von Atomen. (S.F.). Von oneonta.edu wiederhergestellt.
- Encyclopædia Britannica. (2011, 7. September). Elektronische Konfiguration. Von britannica.com wiederhergestellt.
- Helmenstine, T. (2017, 7. März). Das Aufbau-Prinzip - Elektronische Struktur und das Aufbau-Prinzip. Von gedankenco.com wiederhergestellt.
- Hunds Regeln. (2015, 18. Juli). Von chem.libretexts.org wiederhergestellt.
- Spektroskopische Notation. (S.F.). Von bcs.whfreeman.com wiederhergestellt.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.