
Was ist die externe Elektronenkonfiguration?

Das elektronische Konfiguration, Auch als elektronische Struktur bezeichnet, ist es die Anordnung von Elektronen in Energieniveaus um einen Atomkern. Nach dem alten Bohr-Atommodell besetzen Elektronen verschiedene Ebenen in Umlaufbahnen um den Kern, von der ersten Schale, die dem Kern K am nächsten liegt, bis zur siebten Schale Q, die am weitesten vom Kern entfernt ist..
In Bezug auf ein verfeinertes quantenmechanisches Modell sind die K-Q-Schalen in eine Reihe von Orbitalen unterteilt, von denen jedes nicht mehr als ein Elektronenpaar einnehmen kann..
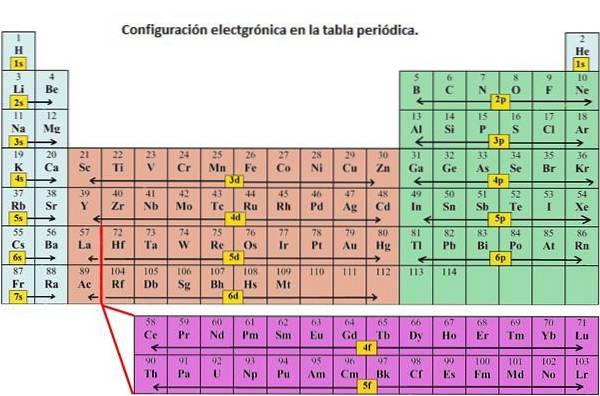
Üblicherweise wird die Elektronenkonfiguration verwendet, um die Orbitale eines Atoms in seinem Grundzustand zu beschreiben, aber sie kann auch verwendet werden, um ein Atom darzustellen, das zu einem Kation oder Anion ionisiert wurde, um den Verlust oder Gewinn von Elektronen in ihren jeweiligen Orbitalen zu kompensieren ..
Viele der physikalischen und chemischen Eigenschaften von Elementen können mit ihren einzigartigen elektronischen Konfigurationen korreliert werden. Valenzelektronen, die Elektronen in der äußersten Schale, sind der bestimmende Faktor für die einzigartige Chemie des Elements..
Grundlagen der Elektronenkonfiguration
Bevor man die Elektronen eines Atoms Orbitalen zuordnet, sollte man sich mit den Grundlagen der Elektronenkonfiguration vertraut machen. Jedes Element im Periodensystem besteht aus Atomen, die aus Protonen, Neutronen und Elektronen bestehen..
Elektronen weisen eine negative Ladung auf und befinden sich um den Atomkern in den Orbitalen des Elektrons, definiert als das Raumvolumen, in dem sich das Elektron mit einer Wahrscheinlichkeit von 95% befindet..
Die vier verschiedenen Arten von Orbitalen (s, p, d und f) haben unterschiedliche Formen, und ein Orbital kann maximal zwei Elektronen aufnehmen. Die p-, d- und f-Orbitale haben unterschiedliche Unterebenen, sodass sie mehr Elektronen aufnehmen können.
Wie angegeben, ist die Elektronenkonfiguration jedes Elements für seine Position im Periodensystem eindeutig. Das Energieniveau wird durch die Periode bestimmt und die Anzahl der Elektronen wird durch die Ordnungszahl des Elements angegeben.
Orbitale mit unterschiedlichen Energieniveaus sind einander ähnlich, nehmen jedoch unterschiedliche Bereiche im Raum ein..
Das 1s-Orbital und das 2s-Orbital haben die Eigenschaften eines s-Orbitals (radiale Knoten, sphärische Volumenwahrscheinlichkeiten, sie können nur zwei Elektronen enthalten usw.). Da sie sich jedoch auf unterschiedlichen Energieniveaus befinden, nehmen sie unterschiedliche Räume um den Kern herum ein. Jedes Orbital kann durch bestimmte Blöcke im Periodensystem dargestellt werden..
Block s ist die Region von Alkalimetallen einschließlich Helium (Gruppen 1 und 2), Block d ist die Übergangsmetalle (Gruppen 3 bis 12), Block p ist die Elemente der Hauptgruppe der Gruppen 13 bis 18, und der f-Block ist die Lanthanid- und Actinid-Reihe.

Aufbauprinzip
Aufbau kommt vom deutschen Wort "Aufbauen", was "bauen" bedeutet. Im Wesentlichen bauen wir durch das Schreiben von Elektronenkonfigurationen Elektronenorbitale auf, wenn wir uns von einem Atom zum anderen bewegen..
Während wir die Elektronenkonfiguration eines Atoms schreiben, füllen wir die Orbitale in aufsteigender Reihenfolge der Ordnungszahl aus.
Das Aufbau-Prinzip stammt aus dem Pauli-Ausschlussprinzip, das besagt, dass ein Atom keine zwei Fermionen (z. B. Elektronen) enthält. Sie können den gleichen Satz von Quantenzahlen haben, so dass sie bei höheren Energieniveaus "stapeln" müssen.
Wie sich Elektronen ansammeln, ist ein Thema der Elektronenkonfiguration (Aufbau Principle, 2015).
Stabile Atome haben so viele Elektronen wie Protonen im Kern. Elektronen sammeln sich in Quantenorbitalen um den Kern nach vier Grundregeln, die als Aufbau-Prinzip bezeichnet werden..
- Es gibt keine zwei Elektronen im Atom, die die gleichen vier Quantenzahlen n, l, m und s teilen.
- Elektronen besetzen zuerst die Orbitale mit dem niedrigsten Energieniveau.
- Die Elektronen füllen die Orbitale immer mit der gleichen Spinzahl. Wenn die Orbitale voll sind, beginnt es.
- Die Elektronen füllen die Orbitale mit der Summe der Quantenzahlen n und l. Orbitale mit gleichen Werten von (n + l) werden zuerst mit den niedrigeren n-Werten gefüllt.
Die zweite und vierte Regel sind grundsätzlich gleich. Ein Beispiel für Regel vier wären die 2p- und 3s-Orbitale.
Ein 2p-Orbital ist n = 2 und l = 2 und ein 3s-Orbital ist in beiden Fällen n = 3 und l = 1. (N + l) = 4, aber das 2p-Orbital hat die niedrigste Energie oder den niedrigsten n-Wert und Willen Füllen Sie vor der Schicht 3s.
Glücklicherweise kann das in Abbildung 2 gezeigte Moeller-Diagramm zum Füllen von Elektronen verwendet werden. Der Graph wird gelesen, indem die Diagonalen von 1s ausgeführt werden.
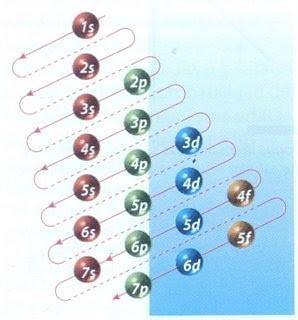
Abbildung 2 zeigt die Atomorbitale und die Pfeile folgen dem Weg nach vorne.
Nachdem bekannt ist, dass die Reihenfolge der Orbitale erfüllt ist, müssen Sie sich nur noch die Größe jedes Orbitals merken.
S-Orbitale haben 1 möglichen Wert von ml 2 Elektronen halten
P-Orbitale haben 3 mögliche Werte von ml 6 Elektronen zu halten
D-Orbitale haben 5 mögliche Werte von ml 10 Elektronen zu halten
F-Orbitale haben 7 mögliche Werte von ml 14 Elektronen zu halten
Dies ist alles, was benötigt wird, um die elektronische Konfiguration eines stabilen Atoms eines Elements zu bestimmen..
Nehmen Sie zum Beispiel das Element Stickstoff. Stickstoff hat sieben Protonen und damit sieben Elektronen. Das erste zu füllende Orbital ist das 1s-Orbital.
Ein s-Orbital hat zwei Elektronen, so dass noch fünf Elektronen übrig sind. Das nächste Orbital ist das 2s-Orbital und enthält die nächsten beiden. Die letzten drei Elektronen gehen in das 2p-Orbital, das bis zu sechs Elektronen aufnehmen kann (Helmenstine, 2017).
Bedeutung der externen Elektronenkonfiguration
Elektronenkonfigurationen spielen eine wichtige Rolle bei der Bestimmung der Eigenschaften von Atomen.
Mit Ausnahme der Ordnungszahl n haben alle Atome derselben Gruppe dieselbe externe elektronische Konfiguration, weshalb sie ähnliche chemische Eigenschaften haben.
Einige der Schlüsselfaktoren, die die atomaren Eigenschaften beeinflussen, sind die Größe der größten besetzten Orbitale, die Energie der Orbitale mit höherer Energie, die Anzahl der freien Orbitalen und die Anzahl der Elektronen in den Orbitalen mit höherer Energie..
Die meisten atomaren Eigenschaften können mit dem Grad der Anziehung zwischen den äußersten Elektronen zum Kern und der Anzahl der Elektronen in der äußersten Elektronenhülle, der Anzahl der Valenzelektronen, in Beziehung gesetzt werden.
Die Elektronen der äußeren Hülle sind diejenigen, die kovalente chemische Bindungen bilden können, sie sind diejenigen, die die Fähigkeit haben, zu Kationen oder Anionen zu ionisieren, und sie sind diejenigen, die den chemischen Elementen den Oxidationszustand verleihen.
Sie bestimmen auch den Atomradius. Wenn n größer wird, nimmt der Atomradius zu. Wenn ein Atom ein Elektron verliert, kommt es aufgrund der Abnahme der negativen Ladung um den Kern zu einer Kontraktion des Atomradius..
Die Elektronen der Außenhülle sind diejenigen, die von der Valenzbindungstheorie, der Kristallfeldtheorie und der Molekülorbitaltheorie berücksichtigt werden, um die Eigenschaften der Moleküle und die Hybridisierungen der Bindungen zu erhalten..
Verweise
- Aufbauprinzip. (2015, 3. Juni). Abgerufen von chem.libretexts: chem.libretexts.org.
- Bozeman Science. (2013, erschöpft 4). Elektronenkonfiguration. Entnommen von youtube: youtube.com.
- Elektronenkonfigurationen und die Eigenschaften von Atomen. (S.F.). Entnommen aus oneonta.edu: oneonta.edu.
- Encyclopædia Britannica. (2011, 7. September). Elektronische Konfiguration. Entnommen aus britannica: britannica.com.
- Faizi, S. (2016, 12. Juli). Elektronische Konfigurationen. Entnommen aus chem.libretexts: chem.libretexts.org.
- Helmenstine, T. (2017, 7. März). Das Aufbau-Prinzip - Elektronische Struktur und das Aufbau-Prinzip. Entnommen ausoughtco :oughtco.com.
- Khan, S. (2014, 8. Juni). Valenzelektronen und Bindung. Entnommen aus der Khanacademy: khanacademy.org.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.