
Proteolysetypen und -funktionen

Das Proteolyse o Der Proteinabbau ist ein Prozess, durch den die Proteine einer Zelle vollständig (bis auf ihre Aminosäurebestandteile) oder teilweise (produzierende Peptide) abgebaut werden können. Das heißt, es besteht aus der Hydrolyse einer oder mehrerer Peptidbindungen, die ihre Aminosäuren zusammenhalten..
Dieser Prozess kann dank der Beteiligung anderer Proteine mit enzymatischer Aktivität stattfinden, in deren aktiven Zentren die Hydrolyse der Bindungen stattfindet. Es kann auch durch nichtenzymatische "Methoden" auftreten, beispielsweise durch Einwirkung von Hitze oder Substanzen mit extremem pH-Wert (sehr sauer oder sehr basisch)..
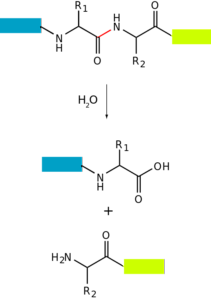
Der Proteinabbau tritt bei Bakterien, Tieren und Pflanzen auf, ist jedoch besonders häufig bei Tieren, insbesondere auf der Ebene des Verdauungssystems, da die Verdauung und intestinale Absorption von Proteinen, die über die Nahrung aufgenommen werden, davon abhängt..
Darüber hinaus ist die Proteolyse für die funktionelle Aufrechterhaltung und Regulation mehrerer zellulärer Prozesse von größter Bedeutung und hat auch mit der Eliminierung jener Proteine zu tun, die Fehler bei Translation, Faltung, Verpackung, Import, Betrieb usw. aufweisen..
Es ist wichtig zu betonen, dass es sich um einen irreversiblen, hochwirksamen Prozess handelt, der auch bei der "Regulation von Regulatoren" funktioniert, da er nicht nur jene Proteine eliminiert, die "direkte" biologische Aktivitäten haben, sondern auch jene, die andere Proteine oder die Expression regulieren der entsprechenden Gene.
Artikelverzeichnis
- 1 Arten der Proteolyse
- 1.1 Ubiquitinierungsproteolyse
- 1.2 Proteolyse durch Autophagie
- 1.3 Nichtenzymatische Proteolyse
- 2 Funktionen
- 2.1 Im Immunsystem
- 2.2 Andere Funktionen
- 2.3 In Pflanzen
- 3 Referenzen
Arten der Proteolyse
Die internen Proteine einer Zelle können zufällig oder selektiv abgebaut werden oder, was auch immer, auf kontrollierte Weise oder nicht. Wie bereits erwähnt, kann dieser Prozess wiederum mittels spezieller Enzyme oder aufgrund definierter Umgebungsbedingungen wie saurem und / oder alkalischem pH-Wert ablaufen..
Es ist wichtig zu erwähnen, dass jedes korrekt translatierte, gefaltete oder verpackte Protein eine oder mehrere Abbausignalsequenzen verbirgt, die "kryptisch" sind und die freigelegt werden können, wenn das Protein durch Temperatur, pH usw. strukturell gestört wird..
Ubiquitinierungsproteolyse
Die Ubiquitinierung (Ubiquitin-Proteasom-System) ist ein System, mit dem Proteine selektiv hydrolysiert werden können, nachdem sie spezifisch für den Abbau markiert wurden. Dieser Prozess kann sowohl im Cytosol als auch im Zellkern stattfinden.
Dieses System hat die Fähigkeit, markierte Proteine im Kern und im Cytosol zu erkennen und zu zerstören sowie Proteine abzubauen, die sich während ihrer Translokation vom Cytosol zum endoplasmatischen Retikulum nicht richtig falten..
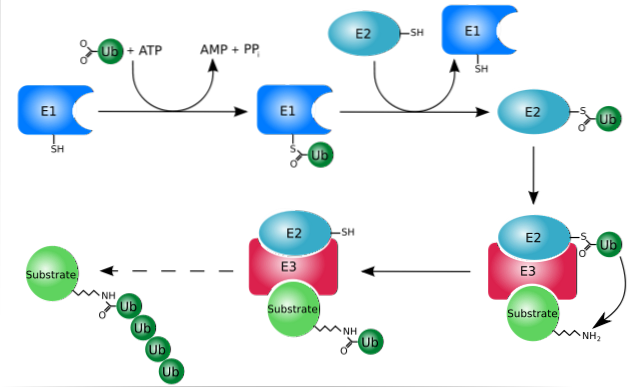
Es funktioniert hauptsächlich durch Hinzufügen oder Konjugieren der "Ziel" -Proteine zu einem kleinen Protein oder Peptid mit 76 Aminosäureresten, besser bekannt als Ubiquitin. Diese durch Ubiquitinierung "markierten" Proteine werden durch das 26S-Proteasom, eine Protease mit mehreren Untereinheiten, in kleine Fragmente abgebaut..
Proteolyse durch Autophagie
Autophagie wird von einigen Autoren auch als eine Form der Proteolyse angesehen, mit dem Unterschied, dass sie in einem geschlossenen Membrankompartiment auftritt, das auf die Lysosomen (in tierischen Zellen) gerichtet ist, wo die darin enthaltenen Proteine durch lysosomale Proteasen abgebaut werden.
Nichtenzymatische Proteolyse
Die Temperatur, der pH-Wert und sogar die Salzkonzentration eines Mediums können die Hydrolyse der Peptidbindungen verursachen, die die Aminosäuren verschiedener Arten von Proteinen zusammenhalten, was durch Destabilisierung und Unterbrechung der Bindungen geschieht..
Eigenschaften
Proteolyse hat in lebenden Organismen viele Funktionen. Insbesondere hat es mit dem Proteinumsatz zu tun, wobei einige spezifische Proteinmoleküle, die von einem oder mehreren Ribosomen translatiert wurden, schließlich mit unterschiedlichen Raten abgebaut werden..
Proteine haben eine Halbwertszeit, die von einigen Sekunden bis zu einigen Monaten variiert, und die Produkte ihres Abbaus, ob reguliert oder nicht, vermittelt durch Enzyme oder nicht, werden im Allgemeinen für die Synthese neuer Proteine wiederverwendet, die wahrscheinlich unterschiedliche Funktionen erfüllen..
Dies geschieht mit Proteinen, die mit der Nahrung aufgenommen werden und im Magen-Darm-Trakt durch Proteasen, einschließlich Trypsin und Pepsin, abgebaut werden. sowie mit einigen zellulären Proteinen, wenn den Zellen genug Nahrung fehlt, um zu überleben.
Intrazelluläre proteolytische Systeme erkennen und eliminieren "abnormale" Proteine, die möglicherweise für Zellen toxisch sind, da sie mit "physiologisch ungeeigneten" Liganden interagieren können, und produzieren Aggregate, die mechanische und physikalische Hindernisse für normale zelluläre Prozesse verursachen..
Die Anreicherung abnormaler Proteine in der Zelle, entweder aufgrund von Defekten im inneren proteolytischen System oder aus anderen Gründen, wird von vielen Wissenschaftlern als eine der Hauptursachen für das Altern bei mehrzelligen Lebewesen angesehen..
Im Immunsystem
Die partielle Proteolyse vieler Proteine aus exogenen oder fremden Quellen, wie beispielsweise eindringende Mikroorganismen, ist ein grundlegender Prozess für das Immunantwortsystem, da T-Lymphozyten die kurzen Fragmente erkennen, ein Produkt der Proteolyse (Peptide), die ihnen präsentiert werden. in Verbindung mit einer Reihe von Oberflächenproteinen.
Diese Peptide können aus dem Ubiquitinierungssystem, autophagischen Prozessen oder unkontrollierten Proteolyseereignissen stammen..
Andere Funktionen
Eine weitere Funktion der begrenzten oder partiellen Proteolyse ist die Modifikation neu gebildeter Proteine, die als "Vorbereitung" für ihre intra- oder extrazellulären Funktionen fungieren. Dies gilt beispielsweise für bestimmte Hormone und für Proteine, die an verschiedenen Stoffwechselprozessen beteiligt sind..
Der programmierte Zelltod (Apoptose) hängt in hohem Maße auch von einer begrenzten oder teilweisen „ortsspezifischen“ Proteolyse intrazellulärer Proteine ab, die durch eine Kaskade spezifischer Proteasen, sogenannte Caspasen, vermittelt wird..
Extrazelluläre Regulationssysteme hängen auch von der ortsspezifischen Proteolyse ab, und das bekannteste Beispiel ist die Blutgerinnung..
Die allgemeine oder vollständige Proteolyse erfüllt auch wesentliche Funktionen für den selektiven Abbau jener Proteine, deren Konzentration in Abhängigkeit von der physiologischen, metabolischen oder Entwicklung der Zellen sorgfältig kontrolliert werden muss..
In Pflanzen
Pflanzen verwenden auch proteolytische Prozesse, um viele ihrer physiologischen und Entwicklungsaspekte zu kontrollieren. Es funktioniert zum Beispiel bei der Aufrechterhaltung intrazellulärer Zustände und bei den Reaktionsmechanismen auf stressige Zustände wie Dürre, Salzgehalt, Temperatur unter anderem..
Wie bei Tieren wirkt die Proteolyse in Pflanzen bei der Aktivierung und Reifung von Zymogenen (inaktiven Proteinen) zusammen, steuert den Stoffwechsel, die Homöostase, programmierte Zelltodprozesse, die Entwicklung von Geweben und Organen usw. In diesen Organismen ist der Weg der Proteolyse durch Ubiquitinierung einer der wichtigsten.
Verweise
- B. Alberts, D. Bray, K. Hopkin, A. D. Johnson, J. Lewis, M. Raff,… & P. Walter (2013). Essentielle Zellbiologie. Girlandenwissenschaft.
- Maurizi, M. R. (1992). Proteasen und Proteinabbau in Escherichia coli. Experientia, 48 (2), 178 & ndash; 201.
- Varshavsky, A. (2005). Geregelter Proteinabbau. Trends in Biochemical Sciences, 30 (6), 283-286.
- Vierstra, R. D. (1996). Proteolyse in Pflanzen: Mechanismen und Funktionen. Bei der posttranskriptionellen Kontrolle der Genexpression in Pflanzen (S. 275-302). Springer, Dordrecht.
- Wolf, D. H. & Menssen, R. (2018). Mechanismen der Zellregulation-Proteolyse, die große Überraschung. FEBS Letters, 592 (15), 2515-2524.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.