
Isobare Prozessformeln, Gleichungen, Experimente, Übungen
In einem isobarer Prozess, der Druck P. eines Systems bleibt konstant. Das Präfix "iso" stammt aus dem Griechischen und wird verwendet, um anzuzeigen, dass etwas konstant bleibt, während "baros", ebenfalls aus dem Griechischen, Gewicht bedeutet.
Isobare Prozesse sind sowohl in geschlossenen Behältern als auch in offenen Räumen sehr typisch, da sie in der Natur leicht zu lokalisieren sind. Damit meinen wir, dass physikalische und chemische Veränderungen auf der Erdoberfläche oder chemische Reaktionen in zur Atmosphäre offenen Behältern möglich sind..
Einige Beispiele werden erhalten, indem ein mit Luft in der Sonne gefüllter Ballon erhitzt, Wasser gekocht, gekocht oder gefroren, in Kesseln erzeugter Dampf oder ein Heißluftballon angehoben wird. Später werden wir diese Fälle erklären.
Artikelverzeichnis
- 1 Formel und Gleichungen
- 2 Experimente
- 2.1 Isobare Prozesse im idealen Gas
- 3 Beispiele
- 3.1 Wasser kochen und kochen
- 3.2 Wasser einfrieren
- 3.3 Erhitzen eines mit Luft in der Sonne gefüllten Ballons
- 3.4 Der Heißluftballon
- 3.5 Kessel
- 4 Gelöste Übungen
- 4.1 Übung 1
- 4.2 Übung 2
- 5 Referenzen
Formel und Gleichungen
Lassen Sie uns eine Gleichung für den isobaren Prozess ableiten, unter der Annahme, dass das untersuchte System ein ideales Gas ist, ein Modell, das für fast jedes Gas mit weniger als 3 Atmosphären Druck gut geeignet ist. Die idealen Gaspartikel bewegen sich zufällig und nehmen das gesamte Volumen des Raums ein, in dem sie sich befinden, ohne miteinander zu interagieren..
Wenn sich das ideale Gas, das in einem mit einem beweglichen Kolben ausgestatteten Zylinder eingeschlossen ist, langsam ausdehnen kann, kann davon ausgegangen werden, dass sich seine Partikel jederzeit im Gleichgewicht befinden. Dann übt das Gas auf den Flächenkolben aus ZU eine Kraft F. von der Größe:
F = p.A.
Wo p ist der Druck des Gases. Diese Kraft übt Arbeit aus, die eine infinitesimale Verschiebung erzeugt dx auf dem Kolben gegeben durch:
dW = Fdx = pA.dx
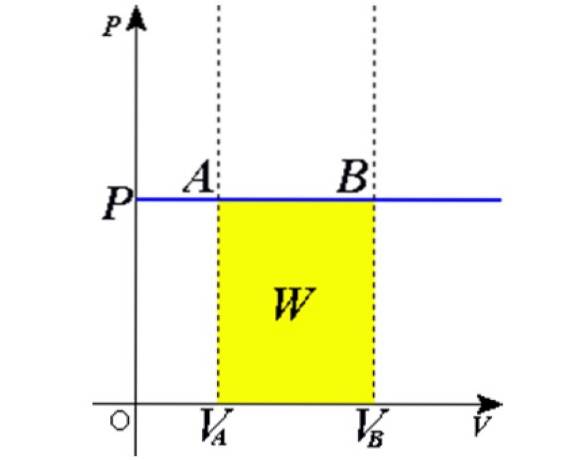
Als Produkt Adx ist ein Volumendifferenz dV, dann dW = pdV. Es bleibt, beide Seiten ab dem ursprünglichen Band zu integrieren V.ZU bis zum endgültigen Volumen V.B. um die gesamte Arbeit mit dem Gas zu erledigen:


Experimente
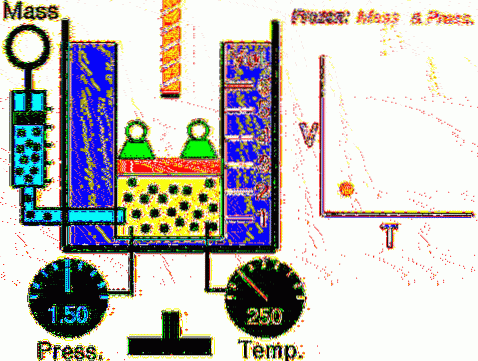
Die beschriebene Situation wird experimentell verifiziert, indem ein Gas in einem Zylinder eingeschlossen wird, der mit einem beweglichen Kolben versehen ist, wie in den 2 und 3 gezeigt. Ein Gewicht der Masse M wird auf den Kolben gelegt, dessen Gewicht nach unten gerichtet ist, während das Gas ausströmt eine Aufwärtskraft dank des auf den Kolben ausgeübten Drucks P..

Da sich der Kolben frei bewegen kann, kann sich das Volumen des Gases problemlos ändern, der Druck bleibt jedoch konstant. Hinzufügen des atmosphärischen Drucks P.Geldautomat, was auch eine nach unten gerichtete Kraft ausübt, haben wir:
Mg - P.A. + P.Geldautomat . A = konstant
Daher gilt: P = (Mg / A) + P.Geldautomat es ändert sich nicht, es sei denn, M und damit das Gewicht werden geändert. Durch Hinzufügen von Wärme zum Zylinder dehnt sich das Gas durch Erhöhen seines Volumens aus oder zieht sich bei der Wärmeentnahme zusammen..
Isobare Prozesse im idealen Gas
Die ideale Gaszustandsgleichung bezieht sich auf die wichtigen Variablen: Druck P, Volumen V und Temperatur T:
P.V = n .R.T
Hier stellt n die Anzahl der Mol dar und R ist die ideale Gaskonstante (gültig für alle Gase), die berechnet wird, indem die Boltzmannsche Konstante mit der Avogadro-Zahl multipliziert wird, was ergibt:
R = 8,31 J / mol K.
Wenn der Druck konstant ist, kann die Zustandsgleichung wie folgt geschrieben werden:
V / T = nR / P.
Aber nR / P ist konstant, da n, R und P sind. Wenn das System von Zustand 1 zu Zustand 2 wechselt, entsteht der folgende Anteil, der auch als Charles'sches Gesetz bekannt ist:
V.1/ T.1 = V.zwei/ T.zwei
Einsetzen in W = PΔV, Die Arbeit, die geleistet wird, um von Zustand 1 zu Zustand 2 zu gelangen, wird in Bezug auf die Konstanten und die Temperaturschwankung erhalten, die mit einem Thermometer leicht zu messen sind:
W.1 → 2 = nR (T.zwei - T.1) = nR.ΔT
Andererseits besagt der erste Hauptsatz der Thermodynamik:
∆U = Q - W.
Dies bedeutet, dass das Hinzufügen einer bestimmten Wärmemenge Q zum Gas die innere Energie ∆U erhöht und die Schwingungen seiner Moleküle erhöht. Auf diese Weise dehnt sich das Gas aus und arbeitet, indem es den Kolben bewegt, wie wir bereits gesagt haben..
In einem einatomigen idealen Gas und der Variation der inneren Energie ∆U, die sowohl die kinetische Energie als auch die potentielle Energie seiner Moleküle umfasst, ist:
∆U = (3/2)nR ΔT
Schließlich kombinieren wir die Ausdrücke, die wir erhalten haben, zu einem:
Q. = ∆U + W = (3/2)nR ΔT + nR∆T = (5/2) nR ΔT
Alternativ kann Q in Bezug auf die Masse m, die Temperaturdifferenz und eine neue Konstante, die aufgerufen wird, umgeschrieben werden spezifische Wärme von Gas bei konstantem Druck abgekürzt cp, deren Einheiten sind J / mol K:
Q = m cp ∆T
Beispiele
Nicht alle isobaren Prozesse werden in geschlossenen Behältern durchgeführt. Tatsächlich treten bei atmosphärischem Druck unzählige thermodynamische Prozesse aller Art auf, so dass isobare Prozesse in der Natur sehr häufig sind. Dies umfasst physikalische und chemische Veränderungen der Erdoberfläche, chemische Reaktionen in zur Atmosphäre offenen Gefäßen und vieles mehr..
Damit isobare Prozesse in geschlossenen Systemen ablaufen können, müssen ihre Grenzen flexibel genug sein, um Volumenänderungen ohne Druckänderung zu ermöglichen.
Dies geschah im Experiment des Kolbens, der sich leicht bewegte, wenn sich das Gas ausdehnte. Das gleiche passiert, wenn ein Gas in einen Partyballon oder einen Heißluftballon eingeschlossen wird.
Hier haben wir einige Beispiele für isobare Prozesse:
Wasser kochen und kochen
Das Kochen von Wasser für Tee oder das Kochen von Saucen in offenen Behältern sind gute Beispiele für isobare Prozesse, da sie alle bei atmosphärischem Druck stattfinden..
Wenn das Wasser erhitzt wird, nehmen Temperatur und Volumen zu und wenn weiterhin Wärme zugeführt wird, ist schließlich der Siedepunkt erreicht, bei dem der Phasenwechsel des Wassers von Flüssigkeit zu Wasserdampf auftritt. Währenddessen bleibt die Temperatur auch konstant bei 100 ° C..
Wasser einfrieren
Andererseits ist das Einfrieren von Wasser auch ein isobarer Prozess, egal ob es im Winter in einem See oder im Haushaltskühlschrank stattfindet..
Erhitzen eines luftgefüllten Ballons in der Sonne
Ein weiteres Beispiel für einen isobaren Prozess ist die Änderung des Volumens eines mit Luft aufgeblasenen Ballons, wenn dieser der Sonne ausgesetzt wird. Als erstes am Morgen, wenn es noch nicht sehr heiß ist, hat der Ballon ein bestimmtes Volumen..
Wenn die Zeit vergeht und die Temperatur steigt, erwärmt sich auch der Ballon, erhöht sein Volumen und dies alles geschieht bei konstantem Druck. Das Material des Ballons ist ein gutes Beispiel für einen Rand, der so flexibel ist, dass sich die Luft im Inneren beim Erhitzen ausdehnt, ohne den Druck zu verändern.
Die Erfahrung kann auch durchgeführt werden, indem der nicht aufgeblasene Ballon in den Auslauf einer Glasflasche eingestellt wird, die mit einem Drittel Wasser gefüllt ist, das in einem Wasserbad erhitzt wird. Sobald das Wasser erhitzt ist, bläst sich der Ballon sofort auf, es muss jedoch darauf geachtet werden, dass er nicht zu stark erwärmt wird, damit er nicht explodiert..
Der aerostatische Ballon
Es ist ein schwimmendes Schiff ohne Antrieb, das Luftströmungen nutzt, um Personen und Gegenstände zu transportieren. Der Ballon ist normalerweise mit heißer Luft gefüllt, die kälter als die Umgebungsluft aufsteigt und sich ausdehnt, wodurch der Ballon aufsteigt..
Obwohl die Luftströmungen den Ballon lenken, verfügt er über Brenner, die aktiviert werden, um das Gas zu erwärmen, wenn es aufsteigen oder die Höhe beibehalten soll, und die beim Abstieg oder bei der Landung deaktiviert werden. All dies geschieht bei atmosphärischem Druck, der in einer bestimmten Höhe unweit der Oberfläche als konstant angenommen wird..

Kessel
In Kesseln wird Dampf erzeugt, indem Wasser erhitzt und der Druck konstant gehalten wird. Danach erfüllt dieser Dampf eine nutzbare Aufgabe, beispielsweise die Stromerzeugung in thermoelektrischen Anlagen oder die Aktivierung anderer Mechanismen wie Lokomotiven und Wasserpumpen..
Gelöste Übungen
Übung 1
Es gibt 40 Liter Gas bei einer Temperatur von 27 ºC. Finden Sie die Volumenzunahme, wenn Wärme isobar hinzugefügt wird, bis 100 ºC erreicht sind.
Lösung
Charles 'Gesetz wird verwendet, um das endgültige Volumen zu bestimmen, aber Beachtung: Die Temperaturen müssen in Kelvin ausgedrückt werden, wobei jeweils 273 K hinzugefügt werden:
27 ºC = 27 + 273 K = 300 K.
100 ºC = 100 + 273 K = 373 K.
Von:
V.1/ T.1 = V.zwei/ T.zwei ⇒ V.zwei = T.zwei(V.1/ T.1) = 373 ºC (40 l / 300 K) = 49,7 l
Schließlich ist die Lautstärkeerhöhung V.zwei - V.1 = 49,7 l - 40 l = 9,7 l.
Übung 2
Lieferung 5,00 x 103 J Energie zu einem idealen Gas, um 2,00 x 10 durchzuführen3 J arbeitet in einem isobaren Prozess an seiner Umgebung. Es wird gebeten zu finden:
a) Die Änderung der inneren Energie des Gases.
b) Die Volumenänderung, wenn nun die innere Energie um 4,50 x 10 abnimmt3 J und 7,50 x 10 werden ausgeworfen3 J des Systems unter Berücksichtigung eines konstanten Drucks von 1,01 x 105 Pa.
Lösung für
Benutzt ∆U = Q - W. und die in der Anweisung angegebenen Werte werden ersetzt: Q = 5,00 x 103 J und W = 2,00 × 103 J:
=5,00 x 103 J - 2,00 x 103 J = 3,00 x 103 J.
Daher erhöht sich die innere Energie des Gases um 3,00 x 103 J..
Lösung b
Die Volumenänderung findet sich in der geleisteten Arbeit: W = P∆V:
∆U = Q - W = Q. - P∆V
Die Aussage besagt, dass die innere Energie abnimmt, daher: ∆U= -4,50 x 103 J. Es sagt uns auch, dass eine bestimmte Wärmemenge ausgestoßen wird: Q = -7,50 x 103 J. In beiden Fällen steht das negative Vorzeichen für Abnahme und Verlust, also:
-4,50 x 103 J = -7,50 x 103 J - P∆V
Wo P = 1,01 x 105 Pa. Da sich alle Einheiten im internationalen System befinden, lösen wir die Volumenänderung auf:
∆V = (-4,50 x 103 J +7,50 x 103 J) / (- 1,01 × 105 Pa) = -2,97 x 10-zwei m3
Da die Volumenänderung negativ ist, bedeutet dies, dass das Volumen abgenommen hat, dh das System hat sich zusammengezogen.
Verweise
- Byjou's. Isobarer Prozess. Wiederhergestellt von: byjus.com.
- Cengel, Y. 2012. Thermodynamik. 7. Auflage. Mcgraw Hügel.
- Prozess xyz. Erfahren Sie mehr über den isobaren Prozess. Wiederhergestellt von: 10proceso.xyz.
- Serway, R., Vulle, C. 2011. Grundlagen der Physik. 9. Aufl. Lernen einbinden.
- Wikipedia. Gasgesetze. Wiederhergestellt von: es.wikipedia.org.

Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.