
Aufbau Prinzip Konzeption und Erklärung, Beispiele
Das Aufbauprinzip Es besteht aus einer nützlichen Anleitung zur theoretischen Vorhersage der elektronischen Konfiguration eines Elements. Das Wort aufbau bezieht sich auf das deutsche Verb "bauen". Die von diesem Prinzip diktierten Regeln sollen "beim Aufbau des Atoms helfen"..
Wenn es um die hypothetische Atomkonstruktion geht, bezieht sie sich ausschließlich auf Elektronen, die wiederum mit der zunehmenden Anzahl von Protonen einhergehen. Protonen definieren die Ordnungszahl Z eines chemischen Elements, und für jedes Element, das dem Kern hinzugefügt wird, wird ein Elektron hinzugefügt, um diesen Anstieg der positiven Ladung zu kompensieren..
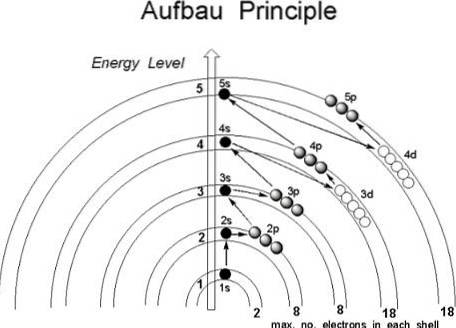
Obwohl es den Anschein hat, dass die Protonen keiner festgelegten Reihenfolge folgen, um sich mit dem Atomkern zu verbinden, folgen die Elektronen einer Reihe von Bedingungen, so dass sie zuerst die Regionen des Atoms mit niedrigerer Energie besetzen, insbesondere diejenigen, in denen die Die Wahrscheinlichkeit, sie im Weltraum zu finden, ist größer: die Orbitale.
Das Aufbau-Prinzip hilft zusammen mit anderen elektronischen Füllregeln (dem Pauli-Ausschlussprinzip und der Hundschen Regel) dabei, die Reihenfolge festzulegen, in der Elektronen zur Elektronenwolke hinzugefügt werden sollen. Auf diese Weise ist es möglich, eine ordnungsgemäße elektronische Konfiguration eines bestimmten chemischen Elements zuzuweisen.
Artikelverzeichnis
- 1 Konzept und Erklärung
- 1.1 Schichten und Unterschichten
- 1.2 Paulis Ausschlussprinzip und Hunds Regel
- 2 Beispiele
- 2.1 Kohlenstoff
- 2.2 Sauerstoff
- 2.3 Calcium
- 3 Einschränkungen des Aufbauprinzips
- 4 Referenzen
Konzept und Erklärung
Wenn das Atom als eine Zwiebel betrachtet würde, würde sich eine endliche Anzahl von Schichten darin befinden, die durch die Hauptquantenzahl n bestimmt wird.
Ferner befinden sich in ihnen die Unterschalen, deren Formen von den Quantenzahlen azimutal l und magnetisch m abhängen.
Die Orbitale werden durch die ersten drei Quantenzahlen identifiziert, während die vierte, der Spin s, anzeigt, in welchem Orbital sich das Elektron befindet. In diesen Bereichen des Atoms drehen sich die Elektronen dann von der innersten zur äußersten Schicht: der Valenzschicht, der energischsten von allen..
In dieser Reihenfolge sollten die Elektronen die Orbitale füllen? Nach dem Aufbau-Prinzip sollten sie anhand des ansteigenden Wertes (n + l) zugeordnet werden..
Ebenso müssen innerhalb der Unterschalen (n + l) die Elektronen die Unterschale mit dem niedrigsten Energiewert besetzen; Mit anderen Worten, sie nehmen den niedrigsten Wert von n ein.
Nach diesen Konstruktionsregeln entwickelte Madelung eine visuelle Methode, die aus dem Zeichnen diagonaler Pfeile besteht, mit deren Hilfe die elektronische Konfiguration eines Atoms erstellt werden kann. In einigen Bildungsbereichen wird diese Methode auch als Regenmethode bezeichnet..
Schichten und Unterschichten
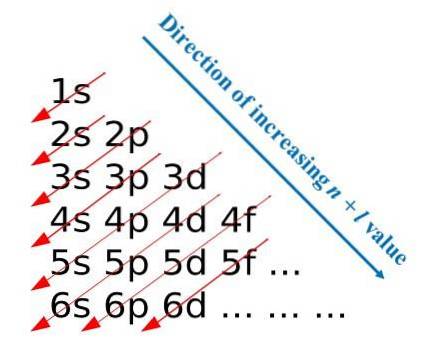
Das erste Bild zeigt ein grafisches Verfahren zum Erhalten der Elektronenkonfigurationen, während das zweite Bild das jeweilige Madelung-Verfahren ist. Die energiereichsten Schichten befinden sich oben und die energiearmsten nach unten..
Von links nach rechts werden die Unterschichten s, p, d und f ihrer entsprechenden Hauptenergieniveaus "durchquert". Wie berechnet man den Wert von (n + l) für jeden Schritt, der durch die diagonalen Pfeile markiert ist? Beispielsweise ist diese Berechnung für das 1s-Orbital gleich (1 + 0 = 1), für das 2s-Orbital (2 + 0 = 2) und für das 3p-Orbital (3 + 1 = 4)..
Das Ergebnis dieser Berechnungen ergibt die Konstruktion des Bildes. Wenn es nicht verfügbar ist, bestimmen Sie einfach (n + l) für jedes Orbital und beginnen Sie, die Orbitale mit Elektronen zu füllen, von dem mit dem niedrigsten Wert von (n + l) bis zu dem mit dem Maximalwert.
Die Verwendung der Madelung-Methode erleichtert jedoch die Konstruktion der Elektronenkonfiguration erheblich und macht sie zu einer unterhaltsamen Aktivität für diejenigen, die das Periodensystem lernen..
Paulis Ausschlussprinzip und Hunds Regel
Die Madelung-Methode zeigt nicht die Orbitale der Unterschalen an. Unter Berücksichtigung dieser Bedingungen besagt das Pauli-Ausschlussprinzip, dass kein Elektron die gleichen Quantenzahlen wie ein anderes haben kann; oder was gleich ist, ein Elektronenpaar kann nicht sowohl positive als auch negative Spins haben.
Dies bedeutet, dass ihre Spinquantenzahlen s nicht gleich sein können und daher ihre Spins sich paaren müssen, wenn sie dasselbe Orbital besetzen.
Andererseits muss das Füllen der Orbitale so erfolgen, dass sie energetisch entartet sind (Hundsche Regel). Dies wird erreicht, indem alle Elektronen in den Orbitalen ungepaart bleiben, bis es unbedingt erforderlich ist, ein Paar davon zu paaren (wie bei Sauerstoff)..
Beispiele
Die folgenden Beispiele fassen das gesamte Konzept des Aufbau-Prinzips zusammen..
Kohlenstoff
Um seine elektronische Konfiguration zu bestimmen, muss zuerst die Ordnungszahl Z und damit die Anzahl der Elektronen bekannt sein. Kohlenstoff hat Z = 6, daher müssen seine 6 Elektronen nach der Madelung-Methode in den Orbitalen lokalisiert werden:

Die Pfeile entsprechen den Elektronen. Nach dem Füllen der 1s und 2s Orbitale mit jeweils zwei Elektronen werden den 2p Orbitalen durch Differenz die verbleibenden zwei Elektronen zugewiesen. Hunds Regel manifestiert sich also: zwei entartete Orbitale und eines leer.
Sauerstoff

Sauerstoff hat Z = 8, also hat er im Gegensatz zu Kohlenstoff zwei zusätzliche Elektronen. Eines dieser Elektronen muss im leeren 2p-Orbital platziert werden, und das andere muss sich paaren, um das erste Paar zu bilden, wobei der Pfeil nach unten zeigt. Folglich manifestiert sich hier das Pauli-Ausschlussprinzip.
Kalzium
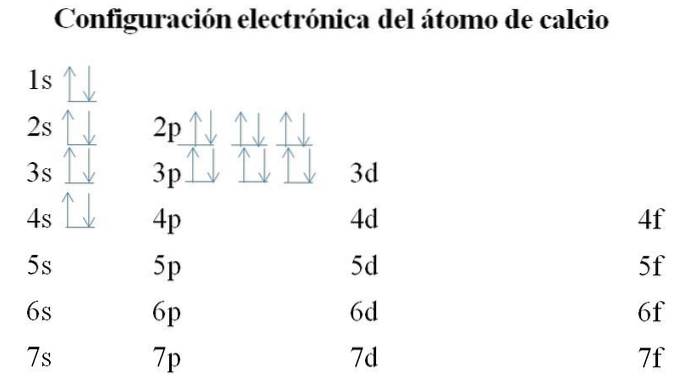
Calcium hat 20 Elektronen und die Orbitale werden immer noch mit der gleichen Methode gefüllt. Die Reihenfolge des Füllens ist wie folgt: 1s-2s-2p-3s-3p-4s.
Es kann angemerkt werden, dass anstatt zuerst das 3d-Orbital zu füllen, die Elektronen die 4s besetzen. Dies geschieht, bevor Übergangsmetallen Platz gemacht werden, Elemente, die die innere Schicht 3d ausfüllen.
Einschränkungen des Aufbauprinzips
Das Prinzip von Aufbau kann die elektronischen Konfigurationen vieler Übergangsmetalle und Seltenerdelemente (Lanthaniden und Actiniden) nicht vorhersagen..
Dies liegt daran, dass die energetischen Unterschiede zwischen den ns- und (n-1) d-Orbitalen gering sind. Aus quantenmechanischen Gründen können Elektronen es vorziehen, die (n-1) d-Orbitale auf Kosten des Rückgängigmachens oder Entfernens von Elektronen aus dem ns-Orbital zu degenerieren.
Ein berühmtes Beispiel ist der Fall von Kupfer. Seine nach dem Aufbau-Prinzip vorhergesagte Elektronenkonfiguration beträgt 1szwei2szwei2 P.63szwei3p64szwei3d9, experimentell wurde gezeigt, dass es 1s istzwei2szwei2 P.63szwei3p64s13d10.
Im ersten Fall ist ein einzelnes Elektron in einem 3D-Orbital ungepaart, während im zweiten Fall alle Elektronen in den 3D-Orbitalen gepaart sind..
Verweise
- Helmenstine, Anne Marie, Ph.D. (15. Juni 2017). Aufbau Prinzip Definition. Entnommen aus :oughtco.com
- Prof. N. De Leon. (2001). Das Aufbau-Prinzip. Entnommen aus: iun.edu
- Chemie 301. Aufbauprinzip. Entnommen aus: ch301.cm.utexas.edu
- Hozefa Arsiwala und Teacherlookup.com. (1. Juni 2017). Im Detail: Aufbauprinzip mit Beispielen. Entnommen aus: Teacherlookup.com
- Whitten, Davis, Peck & Stanley. Chemie. (8. Aufl.). CENGAGE Learning, S. 199-203.
- Goodphy. (27. Juli 2016). Schema von Madelung. [Zahl]. Entnommen aus: commons.wikimedia.org



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.