
Struktur, Eigenschaften, Verwendung, Produktion von Wasserstoffperoxid (H2O2)
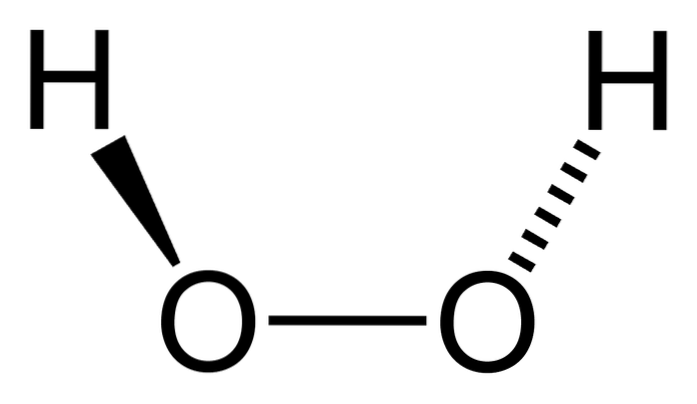
Das Wasserstoffperoxid ist eine anorganische Verbindung, deren chemische Formel H istzweiODERzwei. Von allen ist es das einfachste Peroxid dieser Familie chemischer Verbindungen. Seine Strukturformel lautet H-O-O-H und ist diese interne sauerstoffhaltige Brücke, die für alle Peroxide charakteristisch ist.
Im Jahr 1818 wurde die H.zweiODERzwei Es wurde von Louies Jacques Thénard identifiziert, der eine chemische Verbindung herstellte, die er damals Wasserstoffperoxid nannte. Es ist eine instabile Verbindung, die sich bei Einwirkung von Licht, Hitze und einigen Metallen zersetzt.
Es ist eine sehr nützliche Verbindung, die zur Desinfektion kleinerer Wunden, zum Aufhellen von Haaren, zur Wasseraufbereitung usw. verwendet wird. Obwohl es schädliche Wirkungen für den Menschen haben kann, kommt es in allen eukaryotischen Zellen von Lebewesen vor, wo es mehrere nützliche Funktionen erfüllt.
Wasserstoffperoxid erzeugt die Oxidation toxischer Substanzen wie Phenole, Ethanol, Formaldehyd usw., Produkte, die von Leber und Nieren ausgeschieden werden. Darüber hinaus trägt es zur Zerstörung von Bakterien bei, die von neutrophilen Leukozyten und Makrophagen phagozytiert werden..
Artikelverzeichnis
- 1 Struktur
- 1.1 Molekül
- 1.2 Umdrehungen
- 1.3 Intermolekulare Wechselwirkungen
- 2 Eigenschaften
- 2.1 Namen
- 2,2 Molmasse
- 2.3 Aussehen
- 2.4 Geruch
- 2.5 Geschmack
- 2.6 Dichte
- 2.7 Schmelzpunkt
- 2.8 Siedepunkt
- 2.9 Löslichkeit in Wasser
- 2.10 Löslichkeit
- 2.11 Octanol / Wasser-Verteilungskoeffizient
- 2.12 Dampfdruck
- 2.13 Dissoziationskonstante
- 2,14 pH
- 2.15 Brechungsindex (nD)
- 2.16 Viskosität
- 2.17 Wärmekapazität
- 2.18 Verdampfungswärme
- 2.19 Stabilität
- 2.20 Korrosion
- 2.21 Zersetzung
- 2.22 Oberflächenspannung
- 2.23 Reaktivität
- 3 Verwendungen
- 3.1 Bleaching
- 3.2 Desinfektionsmittel
- 3.3 Reinigungsmittel
- 3.4 Kosmetische Anwendung
- 3.5 Treibmittel
- 4 Erhalten
- 4.1 Hydrierung
- 4.2 Filtration
- 4.3 Oxidation
- 4.4 Extraktion und Reinigung
- 5 Risiken
- 6 Referenzen
Struktur
Molekül
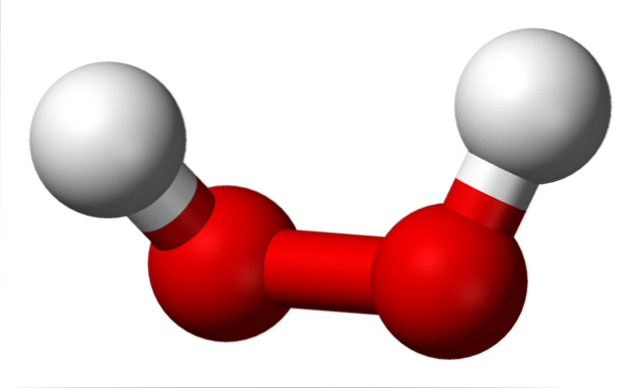
Das obere Bild zeigt die Struktur des H-MolekülszweiODERzwei (H-O-O-H), wobei die roten Kugeln den Sauerstoffatomen und die weißen den Wasserstoffatomen entsprechen. Beachten Sie, dass das Molekül nicht flach ist und dass die H-Atome im Raum nicht verdunkelt sind (übereinander)..
Interessanterweise zum H.zweiODERzwei Es ist schwierig für ihn, seine zentrale einfache O-O-Bindung zu drehen, so dass die Positionen dieser Hs nicht vertauscht werden können; einer geht nicht runter, während der andere rauf geht.
Warum? Denn in den beiden Sauerstoffatomen befinden sich zwei freie Elektronenpaare, was insgesamt acht sehr nahe Elektronen ergibt, die sich aufgrund ihrer negativen Ladungen gegenseitig abstoßen..
Rotationen
Trotzdem kann die O-O-Bindung aufgrund von Wechselwirkungen mit ihrer Umgebung leicht rotieren..
Wenn Sie beispielsweise die beiden Daumen mit ausgestreckten und geschlossenen Zeigefingern zusammenbringen, als ob Sie ein Spielfeld zeichnen würden, und dann die Daumen so drehen, dass einer der Zeigefinger nach vorne und der andere nach hinten zeigt, werden Sie haben eine ungefähre Darstellung von H.zweiODERzwei.
Wenn ein Körper einen Zeigefinger berührt, drehen sich die Daumen als Reaktion auf diese Interaktion. Aufgrund der oben genannten elektronischen Abstoßungen kehren sie jedoch sofort zu ihrer ursprünglichen Position zurück. Diese Rotationen rahmen somit die dynamischen Aspekte dieses Moleküls ein.
Intermolekulare Wechselwirkungen
Im flüssigen Zustand ist der H.zweiODERzwei schafft es, Wasserstoffbrücken (HOOH-O) herzustellenzweiH.zwei), da sonst sein im Vergleich zu Wasser hoher Siedepunkt (150 ºC) nicht erklärt würde.
Sobald es in die Gasphase übergeht, werden die H-MolekülezweiODERzwei vermutlich kann es solche Brücken nicht mehr bilden, nicht nur aufgrund des größeren intermolekularen Abstands, sondern auch der Wasserstoffatome, die sich bei Kollisionen als erste berühren (dies kann durch erneuten Rückgriff auf das Fingermodell sichtbar gemacht werden)..
In der festen Phase beträgt der Winkel der durch das H festgelegten Ebenen 90 ° (Zeigefinger senkrecht stellen). Jetzt werden Wasserstoffbrückenbindungen noch wichtiger und H-MolekülezweiODERzwei sind in einem Kristall von tetragonaler Struktur angeordnet.
Eigenschaften
Flasche mit Wasserstoffperoxid. In Apotheken wird es mit einer Konzentration von 3% m / v erreicht. Quelle: Pixnio.
Namen
-Wasserstoffperoxid
-Antioxidan
-Oxidanol
-Perhydroxinsäure
-O-Hydroxyol
-Peroxid
Molmasse
34,0147 g / mol
Aussehen
Hellblaue (konzentrierte) oder farblose Flüssigkeit. Es ist etwas viskoser und dichter als Wasser. Es wird aus Sicherheitsgründen bei niedrigen Temperaturen und unter vermindertem Druck destilliert, da es sich beim Erhitzen in explosiver Form zersetzt.
Geruch
Scharfer oder ozonartiger Geruch.
Geschmack
Bitter
Dichte
Feststoff 1,71 g / cm3
Die Dichten seiner wässrigen Lösungen hängen von ihrer Konzentration ab; Beispielsweise hat es bei 27% eine Dichte von 1,10 g / cm3, während bei 50% 1,13 g / cm3
Schmelzpunkt
- 0,43 ºC
Siedepunkt
150,2 ° C. Dieser Wert wurde durch Extrapolation erhalten, da sich Wasserstoffperoxid bei hohen Temperaturen zersetzt.
Wasserlöslichkeit
Mischbar ≥ 100 mg / ml bei 25 ºC
Löslichkeit
Es ist in Ether und Alkoholen löslich, in Petrolether jedoch unlöslich. Zersetzt sich in vielen organischen Lösungsmitteln in Wasser und Sauerstoff.
Octanol / Wasser-Verteilungskoeffizient
Log P = - 0,43
Dampfdruck
5 mmHg bei 30 ºC.
Dissoziationskonstante
pKa = 11,72
pH
Wasserstoffperoxidlösungen sind leicht sauer. Zum Beispiel hat ein 35% einen pH von 4,6; Durch Konzentration bei 90% wird der pH-Wert jedoch weniger sauer: 5,1.
Brechungsindex (nD.)
1,4061
Viskosität
1.245 cPoise bei 20 ºC.
Wärmekapazität
1,267 J / gK (Gas)
2,619 J / gK (flüssig)
Verdampfungswärme
1,519 J / gK
Stabilität
Stabil unter empfohlenen Bedingungen. Es wird durch Zugabe von Acetanilid und Zinnsalzen weiter stabilisiert.
Korrosion
Ätzend
Zersetzung
Es zersetzt sich bei Lichteinwirkung oder in Gegenwart von oxidierenden und reduzierenden Substanzen. Es zersetzt sich auch beim Erhitzen. Wenn es sich zersetzt, setzt es Wasser und Sauerstoff frei und wird durch einen Anstieg des pH-Werts und der Temperatur sowie durch das Vorhandensein des Enzyms Katalase begünstigt..
Oberflächenspannung
80,4 Dyn / cm bei 20 ° C.
Reaktivität
Die H.zweiODERzwei Es wirkt als Oxidationsmittel in sauren Lösungen von Eisen (Fe)zwei+) zu Eisen (F)3+); oxidiert auch das Sulfition (SO3zwei-) zu Sulfationen (SO4zwei-).
Es kann auch in Gegenwart basischer Lösungen als Reduktionsmittel wirken und Natriumhypochlorit (NaOCl) und Kaliumpermanganat (KMnO) reduzieren4) unter Freisetzung von Sauerstoff.
Anwendungen
Bleaching
Wasserstoffperoxid wird in der Papierindustrie beim Bleichen von Zellstoff und Papier verwendet, das den größten Teil seiner Jahresproduktion verbraucht.
Desinfektionsmittel
Wasserstoffperoxid ist ein mildes Antiseptikum, um Infektionen kleiner Wunden, Kratzer und Verbrennungen zu verhindern. Es wird auch als Mundwasser und zur Linderung von leichten Reizungen des Mundes aufgrund von Krebsgeschwüren oder Gingivitis verwendet..
Es wird auch verwendet, um Oberflächen, das Innere von Kühlschränken und Wasser zu desinfizieren und übermäßiges Bakterienwachstum in Wassersystemen und Kühltürmen zu bekämpfen. Wasserstoffperoxid setzt freie Sauerstoffradikale frei, die Schadstoffe abbauen.
Waschmittel
Wasserstoffperoxid wird bei der Herstellung von Waschbleichmitteln, einschließlich Natriumpercarbonat, verwendet. Diese Verbindung ist ein Komplex aus Natriumcarbonat und Wasserstoffperoxid, der sich, wenn er in Wasser gelöst wird, in seine Bestandteile trennt.
Kosmetische Anwendung
Verdünntes Wasserstoffperoxid wird beim Bleichen der Haare vor dem Färben verwendet. Es wird auch verwendet, um Zähne aufzuhellen, sowie als Teil einer hausgemachten Zahnpasta.
Treibmittel
Wasserstoffperoxid wird als Monotreibstoff oder oxidierende Komponente einer bipropolenten Rakete verwendet. Es zersetzt sich unter Freisetzung von Sauerstoff und Wasser, eine Eigenschaft, die seine Verwendung als Treibmittel ermöglichte.
Es wird in Gegenwart eines Katalysators, der die Zersetzung beschleunigt, in eine Reaktionszelle gepumpt. Dabei entsteht ein Hochtemperaturwasserdampf.
Wenn der Dampf durch einen Spalt ausgestoßen wird, erzeugt er einen Impuls. Das 1940 gebaute U-Boot V-80 verwendete in seinen Turbinen Sauerstoff aus Wasserstoffperoxid. genannt Walters Turbinensystem.
Erhalten
Anfänglich wurde Wasserstoffperoxid industriell durch Hydrolyse von Ammoniumpersulfat erhalten [(NH4)zweiS.zweiODER8] oder die Elektrolyse von Ammoniumbisulfat, NH4HSO4.
Wasserstoffperoxid wird derzeit industriell durch Verwendung von Anthrachinon erhalten. Das Verfahren wird in vier Stufen durchgeführt: Hydrierung, Filtration, Oxidation, Extraktion und Reinigung..
Hydrierung
Alkylantrochinon wird hydriert, indem Wasserstoffgas durch einen mit Aluminiumoxid und einer kleinen Menge des Katalysators (Palladium) beladenen Hydrogenator geleitet wird. Die Temperatur wird unter ständigem Rühren bei 45 ° C gehalten.
Alkyldrochinon wird in Alkylanthrahydrochinon und Tetrahydroalkylanthrahydrochinon umgewandelt, wobei letzteres aufgrund seiner größeren Bequemlichkeit für die folgenden Verfahren ausgewählt wird.
Filtration
Die Lösung, die das hydrierte Anthrachinon enthält, wird filtriert, um Spuren des Katalysators zu entfernen, den es enthalten kann..
Oxidation
Die filtrierte Lösung wird oxidiert, indem Luft durch sie geleitet wird, wobei Wasserstoffperoxid niedriger Reinheit gebildet wird..
Extraktion und Reinigung
Die Lösung mit dem Wasserstoffperoxid passiert eine Flüssig-Flüssig-Extraktionssäule. Das Wasser fließt durch die Säule, während die Lösung mit dem Wasserstoffperoxid durch sie gepumpt wird.
Das Wasser erreicht den Boden des Extraktors mit einer Wasserstoffperoxidkonzentration zwischen 25 und 35 Gew .-%. Dann wird es durch Vakuumdestillation auf eine Wasserstoffperoxidkonzentration von 30% gereinigt. Endlich stabilisiert und lagert.
Risiken
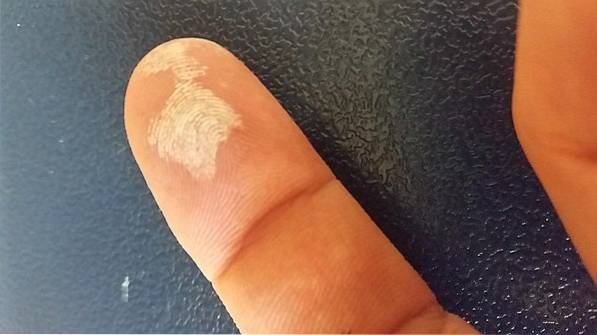
Wasserstoffperoxid ist ein ätzendes Mittel und verursacht bei Hautkontakt starke Reizungen sowie eine vorübergehende Aufhellung (Bild oben). Es kann auch Augenschäden, Juckreiz, Hautausschlag, Rötung und Blasenbildung verursachen..
Das Einatmen führt zu Reizungen der Nase, des Rachens und der Lunge. In der Zwischenzeit kann eine wiederholte Exposition zu Bronchitis, Husten, Schleim und Atemnot führen. Und als ob es nicht genug wäre, erzeugt es auch Kopfschmerzen, Schwindel, Übelkeit und Erbrechen.
Bei starker Einwirkung von Wasserstoffperoxid kann sich Flüssigkeit in der Lunge ansammeln, was als Lungenödem bezeichnet wird - eine schwerwiegende Erkrankung, die sofortige ärztliche Hilfe erfordert..
Die Arbeitsschutzbehörde (OSHA) hat den maximal zulässigen Wert für Wasserstoffperoxid von 1 ppm in einer Arbeitsumgebung in einer 8-Stunden-Schicht festgelegt. Da es sich jedoch um eine mutagene Verbindung handelt, sollte die Exposition auf ein Minimum beschränkt werden..
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2019). Wasserstoffperoxid. Wiederhergestellt von: en.wikipedia.org
- William R. Busing und Henri A. Levy. (2004). Kristall- und Molekülstruktur von Wasserstoffperoxid: Eine Neutronenbeugungsstudie. doi.org/10.1063/1.1696379
- Nationales Zentrum für Informationen zur Biotechnologie. (2019). Wasserstoffperoxid. PubChem-Datenbank. CID = 784. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Die Herausgeber der Encyclopaedia Britannica. (27. November 2018). Wasserstoffperoxid. Encyclopædia Britannica. Wiederhergestellt von: britannica.com
- Gesundheitsministerium von New Jersey. (2016). Wasserstoffperoxid. [PDF]. Wiederhergestellt von: nj.gov
- C. K. Mathews, K. E. Van Holde, K. G. Ahern (2002). Biochemie. Dritte Edition. Herausgeber Pearson Addison Wesley
- Web MD. (2019). Wasserstoffperoxid. Wiederhergestellt von: webmd.com


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.