
Pentanon chemische Struktur, Eigenschaften, Synthese, Verwendung
Das Pentanon ist eine organische Verbindung aus der Ketonfamilie, deren chemische Formel C lautet5H.10O. Es ist immer noch eines der einfachsten Ketone und besteht aus einer farblosen Flüssigkeit mit einem aretonähnlichen Aroma. Von diesem Punkt an zeigen Ketone in Bezug auf die Kohlenstoffzahl ihres Gerüsts eine Positionsisomerie.
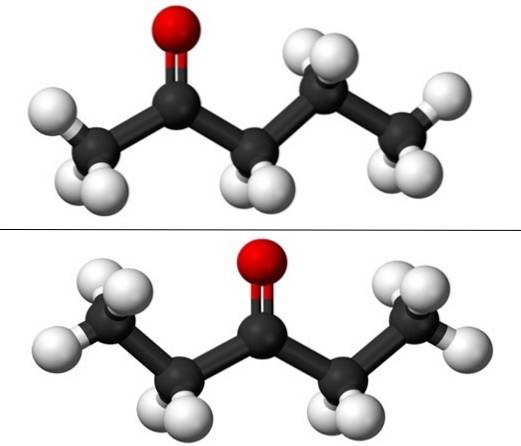
Wenn von Positionsisomerie die Rede ist, bezieht sie sich darauf, wo sich die Carbonylgruppe befindet, C = O. Somit besteht Pentanon tatsächlich aus zwei Verbindungen mit physikalisch unterschiedlichen Eigenschaften, die sich geringfügig voneinander unterscheiden: 2-Pentanon und 3-Pentanon (unteres Bild). Beide sind flüssig, aber ihre Siedepunkte sind gleich, so dass sie nicht durch Destillation getrennt werden können..
Jedes der beiden Pentanone hat jedoch seinen eigenen Syntheseweg, so dass es unwahrscheinlich ist, dass es eine Mischung aus diesen gibt. Mischung, die durch Einfrieren getrennt werden kann.
Ihre Verwendung als organische Lösungsmittel ist besonders eingeschränkt; Alternativen zu Aceton in Umgebungen, in denen es bei einer Temperatur verwendet wird, die höher als sein niedriger Siedepunkt ist. Ebenso sind sie Ausgangsmaterialien für andere organische Synthesen, da ihre C = O-Gruppe reduziert oder nukleophil addiert werden kann..
Artikelverzeichnis
- 1 Chemische Struktur
- 1.1 Positionsisomere
- 1.2 Intermolekulare Wechselwirkungen
- 1.3 Kristalle
- 2 Eigenschaften
- 2.1 Aussehen
- 2,2 Molmasse
- 2.3 Dichte
- 2.4 Schmelzpunkt
- 2,5 Siedepunkt
- 2.6 Löslichkeit in Wasser
- 2.7 Dampfdruck
- 2.8 Flammpunkt
- 2.9 Stabilität
- 3 Synthese
- 3,1 2-Pentanon
- 3,2 3-Pentanon
- 4 Verwendungen
- 5 Referenzen
Chemische Struktur
Positionsisomere
Im Bild haben wir die molekularen Strukturen der beiden Positionsisomere für Pentanon, dargestellt durch ein Modell von Kugeln und Balken. Die schwarzen Kugeln entsprechen den Kohlenstoffgerüsten, die weißen den Wasserstoffatomen und die roten den Sauerstoffatomen der C = O-Gruppe..
2-Pentanon
Das 2-Pentanon (oben) hat im zweiten Kohlenstoff die Gruppe C = O, was derjenigen im vierten entspricht; Das heißt, 2-Pentanon und 4-Pentanon sind äquivalent, da es ausreicht, sie um 180 ° zu drehen, damit ihre Strukturen gleich sind.
Links von C = O befindet sich ein Methylradikal, CH3-, und zu seiner Rechten ein Propylradikal. Aus diesem Grund wird dieses Keton auch als (weniger häufig verwendetes) Methylpropylketon (MPK) bezeichnet. Sie sehen die Asymmetrie dieser Struktur auf den ersten Blick.
3-Pentanon
3-Pentanon (unten) hat am dritten Kohlenstoff die Gruppe C = O. Beachten Sie, dass dieses Isomer eine größere Version von Aceton ist und dass es auch sehr symmetrisch ist; Die beiden Radikale an den Seiten der C = O-Gruppe sind gleich: zwei Ethylradikale, CH3CHzwei-. Aus diesem Grund wird 3-Pentanon auch als Diethylketon (oder Dimethylaceton) bezeichnet..
Intermolekulare Wechselwirkungen
Das Vorhandensein der Carbonylgruppe sowohl in 2-Pentanon als auch in 3-Pentanon verleiht dem Molekül Polarität.
Daher können beide Pentanonisomere durch Dipol-Dipol-Kräfte miteinander interagieren, wobei die höchste Dichte der negativen Ladung δ-, die in einer elektrostatischen Potentialkarte zu sehen ist, um das Sauerstoffatom herum ausgerichtet ist..
Ebenso greifen die Londoner Dispersionskräfte in geringerem Maße zwischen den karbonisierten und hydrierten Skeletten ein..
Da Pentanon im Vergleich zu Aceton eine größere Molekülfläche und Masse hat, trägt dieser Beitrag zu seinem Dipolmoment bei und ermöglicht einen höheren Siedepunkt (102 ºC> 56 ºC). Tatsächlich verdampfen die beiden Isomere bei 102 ° C; beim Einfrieren bei verschiedenen Temperaturen.
Kristalle
Wahrscheinlich spielen Symmetrien eine wichtige Rolle bei der Kristallisation. Beispielsweise beträgt der Schmelzpunkt von 2-Pentanon -78 ºC, während der von 3-Pentanon -39 ºC beträgt.
Dies bedeutet, dass 3-Pentanonkristalle temperaturstabiler sind; Seine Moleküle sind kohäsiver und benötigen mehr Wärme, um sich in der flüssigen Phase zu trennen.
Wenn es eine Mischung beider Isomere gäbe, würde das 3-Pentanon als erstes kristallisieren, wobei das 2-Pentanon zuletzt bei einer niedrigeren Temperatur ist. Die symmetrischeren 3-Pentanon-Moleküle orientieren sich leichter als die von 2-Pentanon: asymmetrisch und gleichzeitig dynamischer.
Eigenschaften
Aussehen
Farblose Flüssigkeiten mit einem aretonähnlichen Aroma.
Molmasse
86,13 g / mol
Dichte
0,81 g / ml (3-Pentanon)
0,809 g / ml (2-Pentanon)
Schmelzpunkt
-78 ºC (2-Pentanon)
-39 ºC (3-Pentanon)
Siedepunkt
102 ºC (für beide Isomere)
Wasserlöslichkeit
35 g / l (3-Pentanon)
60 g / l (2-Pentanon)
Dampfdruck
35 mmHg (3-Pentanon)
270 mmHg (2-Pentanon) bei 20 ° C.
Diese Werte sind nicht nützlich, um die Dampfdrücke beider Isomere direkt zu vergleichen, da der erste ohne die Temperatur angegeben wird, bei der er gemessen wurde..
Flammpunkt
12,78 ° C (3-Pentanon)
10 ºC (2-Pentanon)
Stabilität
Die beiden Pentanonisomere sind extrem entflammbar, daher sollten sie so weit wie möglich von Wärmequellen entfernt sein. Die Flammpunkte zeigen an, dass eine Flamme die Dämpfe beider Pentanone auch bei einer Temperatur von 10 ° C entzünden kann..
Synthese
Obwohl die beiden Isomere von Pentanon physikalisch und chemisch sehr ähnlich sind, sind ihre Synthesewege unabhängig voneinander, so dass es unwahrscheinlich ist, dass beide in derselben Synthese erhalten werden.
2-Pentanon
Ausgehend von dem Reagenz 2-Pentanol, einem sekundären Alkohol, kann es unter Verwendung der in situ gebildeten Hypochlorsäure HClO als Oxidationsmittel zu 2-Pentanon oxidiert werden. Die Oxidation wäre:
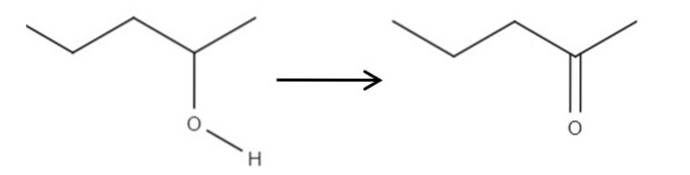
Einfach wird die C-OH-Bindung zu C = O. Es gibt andere Methoden zur Synthese von 2-Pentanon, aber von alledem ist dies am einfachsten zu verstehen..
3-Pentanon
3-Pentanon kann durch ketonische Decarboxylierung von Propansäure CH synthetisiert werden3CHzweiCOOH. Dieser Syntheseweg produziert symmetrische Ketone und besteht aus einem CH-Molekül3COOH verliert die COOH-Gruppe als COzwei, während der andere seine OH-Gruppe in Form von H.zweiODER:
2CH3CHzweiCOOH => CH3CHzweiWagenzweiCH3 + COzwei + H.zweiODER
Ein anderer, etwas komplexerer Weg besteht darin, ein Gemisch aus Ethylen, CH, direkt zu reagierenzwei= CHzwei, COzwei und H.zwei um 3-Pentanon zu bilden.
Anwendungen
Sofern die Anwendung nicht sehr streng ist, es sich um eine spezifische Synthese handelt oder auch gezeigt wurde, dass die beiden Isomere nicht die gleichen Ergebnisse liefern, ist es irrelevant, bei einer ihrer Anwendungen zwischen 2-Pentanon und 3-Pentanon zu wählen..
Mit anderen Worten, "es spielt keine Rolle", ob Sie 2-Pentanon oder 3-Pentanon als Lösungsmittel für Farben oder Harze oder als Entfetter verwenden möchten, da die wichtigsten Kriterien der Preis und die Verfügbarkeit sind. 3-Pentanon wird in der Automobilindustrie verwendet, um das Verhalten von Gasen in Verbrennungsmotoren zu untersuchen.
Verweise
- Morrison, R. T. und Boyd, R., N. (1987). Organische Chemie. 5. Auflage. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Graham Solomons T. W., Craig B. Fryhle. (2011). Organische Chemie. Amine. (10. Auflage). Wiley plus.
- Wikipedia. (2019). 3-Pentanon. Wiederhergestellt von: en.wikipedia.org
- Nationales Zentrum für Informationen zur Biotechnologie. (2019). 2-Pentanon. PubChem-Datenbank. CID = 7895. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Royal Society of Chemistry. (2019). 3-Pentanon. Wiederhergestellt von: chemspider.com
- Professor T. Nalli. (2013). Oxidation von 2-Pentanol und Destillation des Produkts. Wiederhergestellt von: course1.winona.edu


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.