
Struktur, Eigenschaften und Verwendung von Berylliumhydroxid (Be (OH) 2)

Das Berylliumhydroxid Es ist eine chemische Verbindung, die aus zwei Molekülen Hydroxid (OH) und einem Molekül Beryllium (Be) besteht. Seine chemische Formel lautet Be (OH)zwei und es ist dadurch gekennzeichnet, dass es eine amphotere Spezies ist. Im Allgemeinen kann es aus der Reaktion zwischen Berylliummonoxid und Wasser gemäß der folgenden chemischen Reaktion erhalten werden: BeO + H.zweiO → Be (OH)zwei
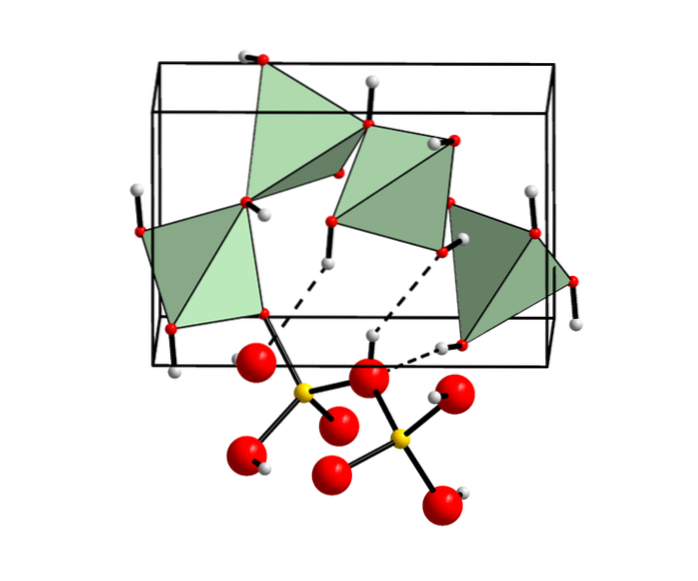
Andererseits hat diese amphotere Substanz eine lineare molekulare Konfiguration. Aus Berylliumhydroxid können jedoch verschiedene Strukturen erhalten werden: Alpha- und Beta-Form als Mineral und in der Dampfphase, abhängig von der verwendeten Methode..
Artikelverzeichnis
- 1 Chemische Struktur
- 1.1 Alpha-Berylliumhydroxid
- 1.2 Beta-Berylliumhydroxid
- 1.3 Berylliumhydroxid in Mineralien
- 1.4 Berylliumhydroxiddampf
- 2 Eigenschaften
- 2.1 Aussehen
- 2.2 Thermochemische Eigenschaften
- 2.3 Löslichkeit
- 2.4 Expositionsrisiken
- 3 Verwendungen
- 4 Erhalten
- 4.1 Metallisches Beryllium erhalten
- 5 Referenzen
Chemische Struktur
Diese chemische Verbindung kann in vier verschiedenen Formen gefunden werden:
Alpha-Berylliumhydroxid
Die Zugabe eines basischen Reagens wie Natriumhydroxid (NaOH) zu einer Berylliumsalzlösung ergibt die alpha (α) -Form von Berylliumhydroxid. Ein Beispiel ist unten gezeigt:
2NaOH (verdünnt) + BeClzwei → Sei (OH)zwei↓ + 2NaCl
2NaOH (verdünnt) + BeSO4 → Sei (OH)zwei↓ + NazweiSW4
Beta-Berylliumhydroxid
Die Degeneration dieses Alpha-Produkts bildet eine metastabile tetragonale Kristallstruktur, die sich nach längerer Zeit in eine rhombische Struktur namens Beta (β) Berylliumhydroxid umwandelt..
Diese Beta-Form wird auch als Niederschlag aus einer Natriumberylliumlösung durch Hydrolyse unter Bedingungen nahe dem Schmelzpunkt erhalten..
Berylliumhydroxid in Mineralien
Obwohl es nicht üblich ist, wird Berylliumhydroxid als kristallines Mineral gefunden, das als Behoit bekannt ist (auf diese Weise in Bezug auf seine chemische Zusammensetzung benannt)..
Es kommt in Granit-Pegmatiten vor, die durch Veränderung von Gadolinit (Mineralien der Gruppe der Silikate) in vulkanischen Fumarolen gebildet werden.
Dieses relativ neue Mineral wurde 1964 zum ersten Mal entdeckt. Derzeit wurden sie nur in Granit-Pegmatiten in den Bundesstaaten Texas und Utah in den USA gefunden..
Berylliumhydroxid-Dampf
Bei Temperaturen über 1200 ° C (2190 ° C) liegt Berylliumhydroxid in der Dampfphase vor. Es entsteht aus der Reaktion zwischen Wasserdampf und Berylliumoxid (BeO).
In ähnlicher Weise hat der resultierende Dampf einen Partialdruck von 73 Pa, gemessen bei einer Temperatur von 1500 ° C..
Eigenschaften
Berylliumhydroxid hat eine ungefähre Molmasse oder ein ungefähres Molekulargewicht von 43,0268 g / mol und eine Dichte von 1,92 g / cm3. Sein Schmelzpunkt liegt bei einer Temperatur von 1000 ° C, bei der er seine Zersetzung beginnt.
Als Mineral ist Be (OH)zwei (behoite) hat eine Härte von 4 und seine Dichte liegt zwischen 1,91 g / cm3 und 1,93 g / cm3.
Aussehen
Berylliumhydroxid ist ein weißer Feststoff, der in seiner Alpha-Form ein gallertartiges und amorphes Aussehen hat. Andererseits besteht die Beta-Form dieser Verbindung aus einer genau definierten, orthorhombischen und stabilen Kristallstruktur..
Man kann sagen, dass die Morphologie des Minerals Be (OH)zwei es ist vielfältig, weil es als retikuläre, arboreszierende Kristalle oder kugelförmige Aggregate gefunden werden kann. Ebenso kommt es in weißen, rosa, bläulichen und sogar farblosen Farben und mit einem fettigen Glaskörperglanz..
Thermochemische Eigenschaften
Bildungsenthalpie: -902,5 kJ / mol
Gibbs-Energie: -815,0 kJ / mol
Bildungsentropie: 45,5 J / mol
Wärmekapazität: 62,1 J / mol
Spezifische Wärmekapazität: 1.443 J / K.
Standard-Bildungsenthalpie: -20,98 kJ / g
Löslichkeit
Berylliumhydroxid hat einen amphoteren Charakter, kann also Protonen abgeben oder aufnehmen und löst sich in sauren und basischen Medien in einer Säure-Base-Reaktion unter Bildung von Salz und Wasser..
In diesem Sinne ist die Löslichkeit von Be (OH)zwei in Wasser ist durch das Löslichkeitsprodukt Kps begrenzt(H 2 O), das entspricht 6,92 × 10-22.
Expositionsrisiken
Die gesetzlich zulässige Expositionsgrenze für Menschen (PEL oder OSHA) einer Berylliumhydroxid-Substanz, definiert für eine maximale Konzentration zwischen 0,002 mg / m3 und 0,005 mg / m3 beträgt 8 Stunden und bei einer Konzentration von 0,0225 mg / m3 eine maximale Zeit von 30 Minuten.
Diese Einschränkungen sind auf die Tatsache zurückzuführen, dass Beryllium als Karzinogen vom Typ A1 eingestuft wird (menschliches Karzinogen, basierend auf der Menge an Beweisen aus epidemiologischen Studien)..
Anwendungen
Die Verwendung von Berylliumhydroxid als Rohstoff für die Verarbeitung einiger Produkte ist sehr begrenzt (und ungewöhnlich). Es ist jedoch eine Verbindung, die als Hauptreagenz für die Synthese anderer Verbindungen und die Gewinnung von metallischem Beryllium verwendet wird..
Erhalten
Berylliumoxid (BeO) ist die in der Industrie am häufigsten verwendete hochreine chemische Berylliumverbindung. Es zeichnet sich als farbloser Feststoff mit elektrischen Isoliereigenschaften und hoher Wärmeleitfähigkeit aus.
In diesem Sinne wird das Verfahren zu seiner Synthese (in technischer Qualität) in der Primärindustrie wie folgt durchgeführt:
- Berylliumhydroxid löst sich in Schwefelsäure (H.zweiSW4).
- Sobald die Reaktion durchgeführt ist, wird die Lösung filtriert, so dass auf diese Weise unlösliche Verunreinigungen von Oxid oder Sulfat beseitigt werden..
- Das Filtrat wird eingedampft, um das Produkt zu konzentrieren, das abgekühlt wird, um Kristalle von Berylliumsulfat BeSO zu erhalten4.
- Der Kuss4 kalziniert bei einer bestimmten Temperatur zwischen 1100 ° C und 1400 ° C..
Das Endprodukt (BeO) wird zur Herstellung spezieller Keramikstücke für den industriellen Einsatz verwendet..
Metallisches Beryllium erhalten
Bei der Extraktion und Verarbeitung von Berylliummineralien entstehen Verunreinigungen wie Berylliumoxid und Berylliumhydroxid. Letzteres wird einer Reihe von Umwandlungen unterzogen, bis das metallische Beryllium erhalten wird.
Be (OH) wird umgesetztzwei mit einer Ammoniumbifluoridlösung:
Sei (OH)zwei + 2 (NH4) HFzwei → (NH4)zweiBeF4 + 2 hzweiODER
Die (NH4)zweiBeF4 wird einer Temperaturerhöhung ausgesetzt, die einer thermischen Zersetzung unterzogen wird:
(NH4)zweiBeF4 → 2NH3 + 2HF + BeFzwei
Schließlich führt die Reduktion von Berylliumfluorid bei einer Temperatur von 1300 ° C mit Magnesium (Mg) zu metallischem Beryllium:
BeFzwei + Mg → Be + MgFzwei
Beryllium wird in Metalllegierungen, der Herstellung elektronischer Komponenten, der Herstellung von Bildschirmen und Strahlungsfenstern für Röntgengeräte verwendet..
Verweise
- Wikipedia. (s.f.). Berylliumhydroxid. Von en.wikipedia.org wiederhergestellt
- Holleman, A. F.; Wiberg, E. und Wiberg, N. (2001). Berylliumhydroxid. Erhalten von books.google.co.ve
- Publishing, M. D. (s.f.). Behoite. Von handbookofmineralogy.org wiederhergestellt
- Alle Reaktionen. (s.f.). Berylliumhydroxid Be (OH)zwei. Von allreactions.com abgerufen
- PubChem. (s.f.). Berylliumhydroxid. Von pubchem.ncbi.nlm.nih.gov wiederhergestellt
- Walsh, K. A. und Vidal, E. E. (2009). Berylliumchemie und -verarbeitung. Erhalten von books.google.co.ve


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.