
Oxyhämoglobin-Eigenschaften, Struktur und Bindungskurve
ODERXihämoglobin Es ist der Name, den Hämoglobin erhält, wenn es an Sauerstoff bindet. Hämoglobin ist ein Protein in roten Blutkörperchen, dessen Hauptfunktion darin besteht, Sauerstoff von der Lunge zum Gewebe zu transportieren..
Die ersten Lebewesen waren einzellig und lebten in einer flüssigen Umgebung, aus der sie ernährt wurden und aus der sie ihren Abfall beseitigten, wie einige der heute existierenden Organismen. Unter diesen Bedingungen werden diese Prozesse durch einfache Diffusionsmechanismen erreicht, da die Zellwand in engem Kontakt mit dem Medium steht, das sie liefert..
Die Entwicklung immer komplexer werdender mehrzelliger Organismen implizierte, dass sich die inneren Zellen erheblich von der Umwelt entfernten, so dass die Diffusionsmechanismen als einzige Bezugsquelle unzureichend wurden..
Daher wurden spezielle Systeme entwickelt, um Nährstoffe und Gase wie das Verdauungssystem und das Atmungssystem zu erhalten, sowie Transportmechanismen, um diese Nährstoffe und Gase näher an die Zelle zu bringen: das Herz-Kreislauf-System.
Um Energie in Form von ATP-Molekülen zu produzieren, benötigen Zellen Sauerstoff. Da ATP nicht gespeichert werden kann, muss es ständig synthetisiert werden, was einen permanenten Sauerstoffbedarf der Zellen bedeutet..
Hämoglobin entwickelte sich evolutionär zu einem Gastransporter, der das Problem des Sauerstofftransports von der Umwelt zur Zelle "löste"..
Artikelverzeichnis
- 1 Eigenschaften und Struktur
- 1.1 Wofür ist Hämoglobin??
- 1.2 Wie ist ein Hämoglobinmolekül??
- 1.3 Wie ist die Hämgruppe??
- 1.4 Wie entsteht Oxyhämoglobin??
- 1.5 Wie viel Sauerstoff kann Hämoglobin maximal transportieren??
- 2 Oxyhämoglobin-Bindungskurve
- 3 Referenzen
Eigenschaften und Struktur
Um über die Eigenschaften und die Struktur von Oxyhämoglobin zu sprechen, muss auf Hämoglobin Bezug genommen werden, da Oxyhämoglobin nichts anderes als an Sauerstoff gebundenes Hämoglobin ist. Daher werden von nun an die Gelenkeigenschaften des Moleküls in Gegenwart oder Nichtvorhandensein des betreffenden Gases beschrieben..
Wofür ist Hämoglobin??
Hämoglobin ist notwendig, um Sauerstoff in der Menge und Geschwindigkeit, die diese rechtfertigen, zu den Geweben zu transportieren, da Sauerstoff im Blut so wenig löslich ist, dass sein Transport durch Diffusion nicht ausreichen würde, um den Gewebebedarf zu decken.
Wie ist ein Hämoglobinmolekül??
Hämoglobin ist ein tetrameres Protein (das vier Untereinheiten aufweist), hat eine Kugelform und eine Molekülmasse von 64 kDa.
Seine vier Untereinheiten bilden eine einzige Funktionseinheit, in der sich beide gegenseitig beeinflussen. Jede Untereinheit besteht aus einer Polypeptidkette, Globin und einer prothetischen Gruppe, der Häm- oder "Häm" -Gruppe, die als Cofaktor fungiert und nicht aus Aminosäuren besteht; Das heißt, es ist kein Protein in der Natur.
Globin kommt in zwei Formen vor: Alpha-Globin und Beta-Globin. Das Hämoglobin-Tetramer besteht aus einem Paar Alpha-Globin-Ketten (mit 141 Aminosäuren) und einem Paar Beta-Globin-Ketten (mit 146 Aminosäuren)..
Jede der vier Polypeptidketten ist an eine Hämgruppe gebunden, deren Zentrum im Eisenzustand (Fe2 +) ein Eisenatom aufweist..
Wie geht es der Hämgruppe??
Die Hämgruppe ist ein Porphyrinring, der aus vier Pyrrolringen (heterocyclischen aromatischen Verbindungen mit der Formel C4H5N) besteht, die durch Methylbrücken verbunden sind. Das Eisen im Eisenzustand, das sich in der Mitte befindet, ist über koordinierte Stickstoffbindungen an die Struktur gebunden.
Jede Hämgruppe kann an ein Sauerstoffmolekül binden, sodass jedes Hämoglobinmolekül nur 4 Moleküle des Gases binden kann.
Der menschliche Körper enthält ungefähr 2,5 x 1013 Erythrozyten, die Blutzellen, die Hämoglobin produzieren und transportieren. Jeder Erythrozyt hat ungefähr 280 Millionen Hämoglobinmoleküle und kann dann mehr als 1 Milliarde Sauerstoffmoleküle tragen.
Wie entsteht Oxyhämoglobin??
Oxyhämoglobin wird nach der Vereinigung eines Sauerstoffatoms mit jedem Eisenatom im Eisenzustand gebildet, der in jeder Hämgruppe des Hämoglobinmoleküls gefunden wird.
Der Begriff Oxyhämoglobin bezieht sich also auf ein sauerstoffhaltiges und nicht chemisch oxidiertes Hämoglobin, da es kein Elektron verliert, wenn es sich mit Sauerstoff verbindet und Eisen in einem Eisenzustand verbleibt..
Die Sauerstoffanreicherung bewirkt eine Änderung der Quartärstruktur des Moleküls, dh eine Änderung der Konformation, die von den Globinketten auf die Hämgruppe und umgekehrt übertragen werden kann..
Was ist die maximale Menge an Sauerstoff, die Hämoglobin tragen kann??
Hämoglobin kann höchstens vier Sauerstoffmoleküle in seiner Struktur binden. Wenn das Molvolumen der idealen Gase 22,4 l / mol beträgt, bindet ein Mol Hämoglobin (64.500 g) an 89,6 Liter Sauerstoff (4 Mol O2 x 22,4 l / mol)..
Jedes Gramm Hämoglobin muss also 1,39 ml O2 binden, um 100% gesättigt zu sein (89,6 l / 64500 g x (1000 ml / l))..
In der Praxis liefern Blutuntersuchungen etwas geringere Ergebnisse, da geringe Mengen an Methämoglobin (oxidiertes Hämoglobin) und Carboxyhämoglobin (Hämoglobin + Kohlenmonoxid (CO)) vorhanden sind, die keinen Sauerstoff binden können.
In Anbetracht dessen legt die Hüfner-Regel fest, dass 1 g Hämoglobin im Blut eine maximale Sauerstoffbindungskapazität von 1,34 ml aufweist.
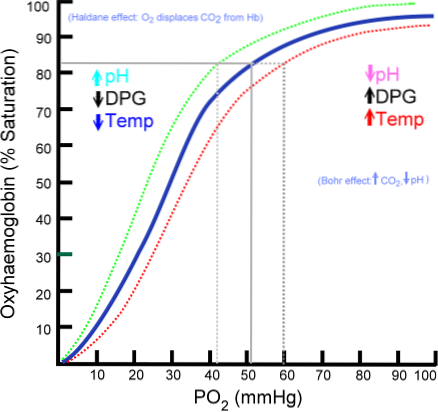
Oxyhämoglobin-Bindungskurve
Die Anzahl der Sauerstoffmoleküle, die an ein Hämoglobinmolekül binden können, hängt vom Partialdruck von Sauerstoff oder PO2 ab. In Abwesenheit von Sauerstoff wird Hämoglobin von Sauerstoff befreit, aber mit zunehmendem PO2 steigt die Anzahl der Sauerstoffatome, die an Hämoglobin binden..
Der Prozess der Bindung von Sauerstoff an Hämoglobin hängt vom Sauerstoffpartialdruck ab. In der Darstellung wird das Ergebnis als "Oxyhämoglobin-Kurve" bezeichnet und hat eine charakteristische "S" - oder Sigmoidform..
Abhängig vom PO2 ist Hämoglobin weniger oder mehr in der Lage, den Sauerstoff, den es trägt, „freizusetzen“ oder „abzugeben“ und mit ihm beladen zu werden..
Beispielsweise wird im Bereich zwischen 10 und 60 mmHg Druck der steilste Teil der Kurve erhalten. In diesem Zustand kann Hämoglobin leicht große Mengen an O2 abgeben. Dies ist der Zustand, der im Gewebe erreicht wird.
Wenn PO2 zwischen 90 und 100 mmHg (12 bis 13 kPa) liegt, ist Hämoglobin fast 100% mit O2 gesättigt; und wenn das arterielle PO2 60 mmHg (8 kPa) beträgt, ist die O2-Sättigung immer noch so hoch wie 90%.
In der Lunge sind dies die vorherrschenden Bedingungen (Druck zwischen 60 und 100 mmHg), und dies ermöglicht es, die in den Erythrozyten vorhandenen Hämoglobinmoleküle mit Sauerstoff zu laden..
Diese Sigmoidform, die die Oxyhämoglobin-Kurve zeichnet, stellt sicher, dass sich dieses Protein im Verhältnis zur lokalen Stoffwechselrate, dh nach Bedarf, als ausgezeichneter Lungenlader, als sehr effizienter Transporter im arteriellen Blut und als ausgezeichneter O2-Spender im Gewebe verhält.
Verweise
- Fox, S. I. (2006). Human Physiology 9th Edition (S. 501-502). McGraw-Hill Press, New York, USA.
- Murray, R.K., Granner, D.K., Mayes, P.A. & Rodwell, V.W. (2014). Harpers illustrierte Biochemie. McGraw-Hill.
- Rawn, J. D. (1998). Biochemistry (1989). Burlington, North Carolina: Neil Patterson Verlag (c) N. Lalioti, CP Raptopoulou, A. Terzis, A. Panagiotopoulos, SP Perlepes, E. Manessi-Zoupa, J. Chem. Soc. Dalton Trans, 1327.
- Robert M. Bern, Matthew N. Levy. (2001) Physiology. (3. Aufl.) Ediciones Harcourt, S.A..
- West, J. B. (1991). Physiologische Grundlagen der medizinischen Praxis. Williams & Wilkins



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.