
Struktur, Eigenschaften, Verwendungen, Risiken der Nitrobenzol (C6H5NO2)
Das Nitrobenzol ist eine aromatische organische Verbindung, die durch einen Benzolring C gebildet wird6H.5- und eine Nitro-NO-Gruppezwei. Seine chemische Formel lautet C.6H.5NICHTzwei. Es ist eine farblose oder hellgelbe ölige Flüssigkeit, die nach Bittermandeln oder Schuhcreme riecht..
Nitrobenzol ist eine sehr nützliche Verbindung in der chemischen Industrie, da es ermöglicht, eine Reihe chemischer Substanzen zu erhalten, die verschiedene Verwendungszwecke haben. Dies liegt daran, dass es verschiedenen Arten von Reaktionen ausgesetzt werden kann.
Wichtige chemische Reaktionen umfassen die Nitrierung (wodurch mehr -NO-Gruppen hinzugefügt werden könnenzwei zum Molekül) und Reduktion (das Gegenteil von Oxidation, da die beiden Sauerstoffatome der Nitro-NO-Gruppe eliminiert werdenzwei und werden durch Wasserstoff ersetzt).
Mit Nitrobenzol können beispielsweise Anilin und para-Paracetamol hergestellt werden. Letzteres ist das bekannte Paracetamol, ein Antipyretikum (Arzneimittel gegen Fieber) und ein mildes Analgetikum (Arzneimittel gegen leichte Schmerzen)..
Nitrobenzol sollte mit Vorsicht behandelt werden, da es reizend und toxisch ist, unter verschiedenen Symptomen eine Art Anämie verursachen kann und vermutlich Krebs verursacht. Es ist auch umweltschädlich.
Artikelverzeichnis
- 1 Struktur
- 2 Nomenklatur
- 3 Eigenschaften
- 3.1 Physikalischer Zustand
- 3.2 Molekulargewicht
- 3.3 Schmelzpunkt
- 3.4 Siedepunkt
- 3.5 Flammpunkt
- 3.6 Selbstentzündungstemperatur
- 3.7 Dichte
- 3.8 Löslichkeit
- 3.9 Chemische Eigenschaften
- 3.10 Dimerbildung
- 3.11 Andere Eigenschaften
- 4 Erhalten
- 5 Verwendungen
- 5.1 Bei der Gewinnung von Anilin und Paracetamol
- 5.2 Bei der Gewinnung anderer chemischer Verbindungen
- 5.3 In verschiedenen Anwendungen
- 6 Risiken
- 7 Behandlungen zur Beseitigung aus der Umwelt
- 8 Referenzen
Struktur
Nitrobenzol C.6H.5-NICHTzwei ist ein flaches Molekül, das von einem Benzolring C gebildet wird6H.5- an die eine Nitro-NO-Gruppe gebunden istzwei. Sein Molekül ist flach, da zwischen der Nitro-NO-Gruppe eine elektronische Wechselwirkung bestehtzwei und der Benzolring.
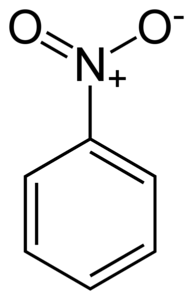
Die Nitro-NO-Gruppezwei neigt dazu, Elektronen vom Benzolring C anzuziehen6H.5-.
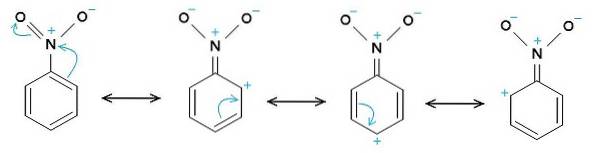
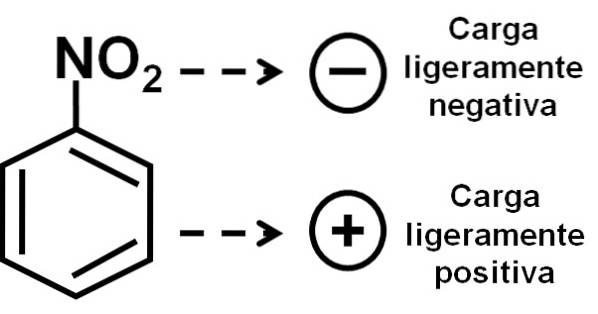
Daher hat das Molekül eine etwas negativere Seite (wo die Sauerstoffatome von -NO sindzwei) und eine etwas positivere Seite (der Benzolring).
Nomenklatur
- Nitrobenzol.
- Nitrobenzin.
- Nitrobenzol.
- Myrban oder Myrbanöl oder Essenz (nicht mehr verwendeter Begriff).
Eigenschaften
Körperlicher Status
Farblose bis hellgelbe ölige Flüssigkeit.
Molekulargewicht
123,11 g / mol.
Schmelzpunkt
5,7 ºC.
Siedepunkt
211 ºC.
Flammpunkt
88 ºC (Methode mit geschlossenem Becher).
Selbstentzündungstemperatur
480 ° C..
Dichte
1,2037 g / cm3 bei 20 ºC.
Löslichkeit
In Wasser schwer löslich: 0,19 g / 100 g Wasser bei 20 ° C. Mit Alkohol, Benzol und Diethylether vollständig mischbar.
Chemische Eigenschaften
Nitrobenzol ist bis zu einer Temperatur von ungefähr 450 ° C stabil, bei der es beginnt, sich zu zersetzen und (in Abwesenheit von Sauerstoff) NO, NO zu bildenzwei, Benzol, Biphenyl, Anilin, Dibenzofuran und Naphthalin.
Wichtige Nitrobenzolreaktionen umfassen Reduktion, Nitrierung, Halogenierung und Sulfonierung..
Die Nitrierung von Nitrobenzol erzeugt anfänglich Metha-Nitrobenzol und mit einer verlängerten Reaktionszeit wird 1,3,5-Nitrobenzol erhalten.
Durch Umsetzen von Brom oder Chlor mit Nitrobenzol in Gegenwart eines geeigneten Katalysators wird 3-Brom-Nitrobenzol (Meta-Bromnitrobenzol) oder 3-Chlornitrobenzol (Meta-Chlornitrobenzol) erhalten..
Ein Beispiel für eine Reduktion ist, dass bei der Behandlung mit Zinn (Sn) in Salzsäure (HCl) die Metahalogenonitrobenzole die Metahalogenananine erhalten.
Die Nitrobenzolsulfonierung wird mit rauchender Schwefelsäure bei 70-80ºC durchgeführt und das Produkt ist Meta-Nitrobenzolsulfonsäure. Dies kann mit Eisen und HCl zu Methanilsäure reduziert werden..
Dimerbildung
In einer Lösung von Benzol C.6H.6 Nitrobenzolmoleküle verbinden sich miteinander, um Dimere oder Molekülpaare zu bilden. In diesen Paaren befindet sich eines der Moleküle in einer umgekehrten Position in Bezug auf das andere..
Die Bildung von Nitrobenzoldimeren mit Molekülen, die sich in einer umgekehrten Position zueinander befinden, ist möglicherweise darauf zurückzuführen, dass jedes von ihnen eine etwas positiv geladene Seite und eine gegenüberliegende Seite eine etwas negativere Ladung aufweist..
Im Dimer befindet sich die Seite mit einer etwas positiveren Ladung eines der Moleküle möglicherweise nahe der leicht negativen Ladung des anderen Moleküls, da sich die entgegengesetzten Ladungen gegenseitig anziehen, und dies ist bei den beiden anderen Seiten der Fall..
Andere Eigenschaften
Hat einen ähnlichen Geruch wie Mandeln oder Schuhcreme. Beim Absenken der Temperatur verfestigt es sich in Form von grünlich-gelben Kristallen.
Erhalten
Erhalten durch Behandeln von Benzol C.6H.6 mit einer Mischung aus Salpetersäure HNO3 und Schwefelsäure H.zweiSW4. Der Prozess wird als Nitrierung bezeichnet und beinhaltet die Bildung des Nitroniumions NOzwei+ dank der Anwesenheit von Schwefelsäure H.zweiSW4.
- NO-Bildung von Nitroniumionenzwei+::
HNO3 + 2 hzweiSW4 ⇔ H.3ODER+ + 2 HSO4- + NICHTzwei+ (Nitroniumion)
- Nitroniumionen greifen Benzol an:
C.6H.6 + NICHTzwei+ → C.6H.6NICHTzwei+
- Nitrobenzol wird gebildet:
C.6H.6NICHTzwei+ + HSO4- → C.6H.5NICHTzwei + H.zweiSW4
Zusammenfassend:
C.6H.6 + HNO3 → C.6H.5NICHTzwei + H.zweiODER
Die Nitrierungsreaktion von Benzol ist sehr exotherm, dh es wird viel Wärme erzeugt, was sehr gefährlich ist.
Anwendungen
Bei der Gewinnung von Anilin und Paracetamol
Nitrobenzol wird hauptsächlich zur Synthese von Anilin C verwendet6H.5NHzwei, Dies ist eine Verbindung, die häufig zur Herstellung von Pestiziden, Gummi, Farbstoffen, Sprengstoffen und Arzneimitteln verwendet wird.
Die Gewinnung von Anilin erfolgt durch Reduktion von Nitrobenzol in einem sauren Medium in Gegenwart von Eisen oder Zinn, was gemäß den folgenden Schritten durchgeführt wird:
Nitrobenzol → Nitrosobenzol → Phenylhydroxylamin → Anilin
C.6H.5NICHTzwei → C.6H.5NEIN → C.6H.5NHOH → C.6H.5NHzwei

Abhängig von den Bedingungen kann der Prozess in einem der Zwischenschritte, beispielsweise Phenylhydroxylamin, gestoppt werden. Ausgehend von Phenylhydroxylamin in einem stark sauren Medium kann para-Aminophenol hergestellt werden:
Phenylhydroxylamin → p-Aminophenol
C.6H.5NHOH → HOC6H.4NHzwei
Letzteres wird mit Essigsäureanhydrid behandelt, um Paracetamol (Paracetamol) zu erhalten, ein bekanntes fiebersenkendes und mildes Analgetikum, dh ein Arzneimittel zur Behandlung von Fieber und Schmerzen..
Ein anderer Weg, um Anilin zu erhalten, besteht darin, Nitrobenzol mit Kohlenmonoxid (CO) in einem wässrigen Medium in Gegenwart sehr kleiner Partikel (Nanopartikel) von Palladium (Pd) als Katalysator zu reduzieren..
C.6H.5-NICHTzwei + 3 CO + H.zweiO → C.6H.5-NHzwei + 3 COzwei
Bei der Gewinnung anderer chemischer Verbindungen
Nitrobenzol ist der Ausgangspunkt, um eine Vielzahl von Verbindungen zu erhalten, die als Farbstoffe, Pestizide, Arzneimittel und Kosmetika verwendet werden.

Beispielsweise ist es möglich, 1,3-Dinitrobenzol zu erhalten, das durch Chlorierung (Zugabe von Chlor) und Reduktion (Eliminierung von Sauerstoffatomen) 3-Chloranilin erzeugt. Dies wird als Zwischenprodukt für Pestizide, Farbstoffe und Arzneimittel verwendet.
Nitrobenzol wurde verwendet, um Benzidin herzustellen, das ein Farbstoff ist. Zusätzlich wird Nitrobenzol verwendet, um unter vielen anderen Verbindungen Chinolin, Azobenzol, Methanilsäure, Dinitrobenzol, Isocyanate oder Pyroxylin herzustellen..
In verschiedenen Anwendungen
Nitrobenzol wird verwendet oder wurde verwendet als:
- Extraktionslösungsmittel zur Reinigung von Schmierölen für Maschinen
- Lösungsmittel für Celluloseether
- Bestandteil der Metallpoliermischung
- In Seifen
- In Schuhpoliermischungen
- Sprühfarbe Konservierungsmittel
- Bestandteil von Bodenpoliermischungen
- Mandelessenzersatz
- In der Parfümindustrie
- Bei der Herstellung von Synthesekautschuk
- Lösungsmittel in verschiedenen Prozessen

Risiken
Nitrobenzol ist durch Einatmen, Verschlucken und Absorption durch die Haut toxisch..
Reizt Haut, Augen und Atemwege. Es kann eine Art von Anämie verursachen, die als Methämoglobinämie bezeichnet wird. Dies führt zu einer Verringerung der Fähigkeit der roten Blutkörperchen, Sauerstoff in das Gewebe freizusetzen, und führt zu Müdigkeit..
Darüber hinaus verursacht Nitrobenzol Atemnot, Schwindel, Sehstörungen, Atemnot, Kollaps und Tod. Es schädigt auch die Leber, Milz, Nieren und das Zentralnervensystem.
Es wird geschätzt, dass es ein Mutagen und möglicherweise eine Ursache für Krebs beim Menschen sein kann, da es es bei Tieren verursacht hat.
Zusätzlich sollte Nitrobenzol nicht in der Umwelt entsorgt werden. Seine Toxizität gegenüber Tieren, Pflanzen und Mikroorganismen macht es sehr schädlich für Ökosysteme.
Die Toxizität gegenüber Mikroorganismen verringert deren biologische Abbaubarkeit.
Behandlungen für seine Beseitigung aus der Umwelt
Eine Kontamination der Umwelt mit Nitrobenzol kann durch Abfälle aus den verschiedenen Industrien erfolgen, in denen es verwendet wird, wie z. B. der Farbstoff- oder Sprengstoffindustrie..
Nitrobenzol ist ein hochgiftiger Schadstoff und unter natürlichen Bedingungen schwer zu zersetzen. Aus diesem Grund kann es zu einer starken Kontamination des Trinkwassers und der Bewässerungssysteme für Nutzpflanzen führen..
Aufgrund seiner hohen Stabilität und Toxizität gegenüber Mikroorganismen wird es häufig als Modell in Abwasserbehandlungsstudien ausgewählt..
Verschiedene Möglichkeiten zur Entfernung von Nitrobenzol aus kontaminiertem Wasser werden untersucht. Eine davon ist der photokatalytische Abbau, dh die Verwendung von Sonnenlicht als Beschleuniger der Abbaureaktion in Gegenwart von Titandioxid-TiOzwei.

Mikroelektrolyseverfahren mit einem Eisen (Fe) - und Kupfer (Cu) -Katalysator in Keramik wurden ebenfalls erfolgreich getestet. Durch Mikroelektrolyse kann Nitrobenzol durch elektrischen Strom abgebaut werden.
Verweise
- UNS. Nationalbibliothek für Medizin. (2019). Nitrobenzol. Von pubchem.ncbi.nlm.nih.gov wiederhergestellt.
- Morrison, R.T. und Boyd, R.N. (2002). Organische Chemie. 6. Auflage. Prentice-Hall.
- Moldoveanu, S.C. (2019). Pyrolyse anderer stickstoffhaltiger Verbindungen. In der Pyrolyse organischer Moleküle (2. Auflage). Von sciencedirect.com wiederhergestellt.
- Smith, P.W.G. et al. (1969). Aromatische Nitrierung-Nitro-Verbindungen. Elektrophile Substitutionen. In der aromatischen Chemie. Von sciencedirect.com wiederhergestellt.
- Windholz, M. et al. (Herausgeber) (1983). Der Merck-Index. Eine Enzyklopädie der Chemikalien, Drogen und Biologika. Zehnte Ausgabe. Merck & CO., Inc..
- Ullmanns Enzyklopädie der Industriechemie. (1990). Fünfte Ausgabe. Band A22. VCH Verlagsgesellschaft mbH.
- Whang, T.-J. et al. (2012). UV-bestrahlter photokatalytischer Abbau von Nitrobenzol durch Titandioxidbindung an Quarzröhrchen. International Journal of Photoenergy, Band 2012, Artikel-ID 681941. Von hindawi.com wiederhergestellt.
- Shikata, T. et al. (2014). Antiparallele Nitrobenzol-Dimerbildung in unpolaren Lösungsmitteln. AIP Advances 4, 067130 (2014). Von doaj.org wiederhergestellt.
- Krogul-Sobczak, A. et al. (2019). Reduktion von Nitrobenzol zu Anilin durch CO / H.zweiO in Gegenwart von Palladium-Nanopartikeln. Katalysatoren 2019, 9, 404. Von mdpi.com wiederhergestellt.
- Yang, B. et al. (2019). Herstellung, Eigenschaften und Anwendung von katalytisch-keramischen Fe / Cu-Füllstoffen im Pilotmaßstab für die Abwasserbehandlung von Nitrobenzolverbindungen. Katalysatoren 2019, 9, 11. Von mdpi.com wiederhergestellt.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.