
Struktur, Eigenschaften und Verwendungen von Kaliumnitrit (KNO2)

Das Kaliumnitrit ist ein anorganisches Salz, dessen chemische Formel KNO istzwei, das chemisch und pharmakologisch mit Kaliumnitrat, KNO, verwandt ist3. Sein physikalisches Erscheinungsbild besteht aus gelblich-weißen Kristallen, die stark hygroskopisch und daher zerfließend sind. Das heißt, sie lösen sich in feuchten Umgebungen schnell auf.
Seine Formel gibt an, dass der Anteil an K-Ionen+ und neinzwei- ist 1: 1 und sie werden durch elektrostatische Kräfte oder Ionenbindungen zusammengehalten. Für seine Kristalle scheinen keine reinen natürlichen Quellen gefunden worden zu sein, obwohl Nitritanionen in Böden, Düngemitteln, Pflanzen und Tieren vorkommen..

Das Bild oben zeigt, wie die KNO-Kristalle aussehenzwei, mit ausgeprägten Gelbtönen. Wenn diese Kristalle mit der Luft in Kontakt bleiben, nehmen sie Feuchtigkeit auf, bis sie zu einer wässrigen Lösung werden. Lösung, die Kontroversen darüber ausgelöst hat, ob ihre Verwendung für medizinische Zwecke von Vorteil ist oder nicht.
Andererseits werden seine Kristalle in sehr geringen Mengen (200 ppm) verwendet, um Fleisch zu salzen und seine Konservierung gegen bakterielle Einwirkung zu gewährleisten. Ebenso der KNOzwei verbessert die Farbe von Fleisch und macht es rötlicher; Es unterliegt jedoch mehreren Einschränkungen, um die toxischen Wirkungen dieses Salzes im Körper zu vermeiden.
Artikelverzeichnis
- 1 Struktur von Kaliumnitrit
- 2 Eigenschaften
- 2.1 Molekularmasse
- 2.2 Dichte
- 2.3 Schmelzpunkt
- 2.4 Siedepunkt
- 2.5 Löslichkeit in Wasser
- 2.6 Zerfließen
- 2.7 Löslichkeit in anderen Lösungsmitteln
- 2,8 pH
- 3 Nomenklatur
- 4 Erhalten
- 5 Verwendungen
- 5.1 Additiv und Reagenz
- 5.2 Gegenmittel
- 5.3 Ärzte
- 6 Referenzen
Struktur von Kaliumnitrit
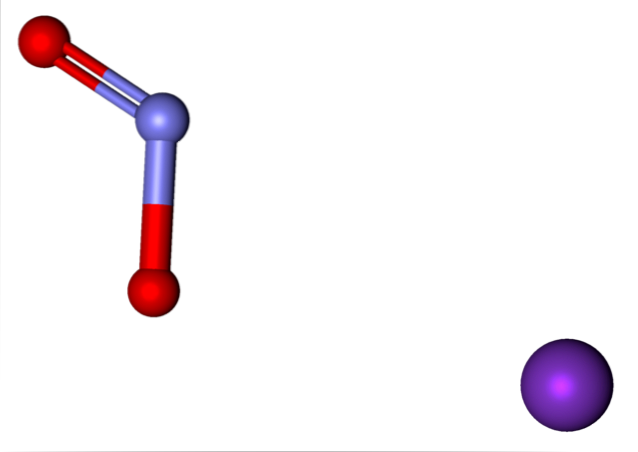
Die in Kaliumnitrit vorhandenen Ionen sind oben gezeigt. Das K-Kation+ entspricht der violetten Kugel, während das NO-Anionzwei- wird durch die bläulichen und roten Kugeln dargestellt.
Anion NRzwei- gezeigt mit einer Doppel- und einer Einfachbindung [O = N-O]-;; In Wirklichkeit sind beide Bindungen das gleiche Produkt der Resonanz der negativen Ladung zwischen ihnen.
K Ionen+ und neinzwei- sie ziehen sich im Raum an, bis sie ein Strukturmuster mit der geringsten Energie organisieren; Hier sind die Abstoßungen zwischen gleichen Ladungen minimal. Und so entstehen KNO-Kristallezwei, deren Einheitszelle ist anfällig für Temperaturänderungen, welche Phasenübergänge.
Zum Beispiel bei niedrigen Temperaturen (weniger als 25 ° C) KNO-Kristallezwei ein monoklines System einführen (Phase I). Wenn die Temperatur 25 ° C überschreitet, tritt ein Phasenübergang von monoklin zu rhomboedrisch (Phase II) auf. Schließlich oberhalb von 40 ° C die KNO-Kristallezwei Wechsel in kubisch (Phase III).
Ebenso der KNOzwei es kann unter hohen Drücken andere kristalline Phasen (Phasen IV, V und VI) aufweisen. Damit sind die K-Ionen+ und neinzwei- Am Ende bewegen und ordnen sie sich in ihren reinen Kristallen auf unterschiedliche Weise.
Eigenschaften
Molekulare Masse
85,1038 g / mol.
Dichte
1,9150 g / ml.
Schmelzpunkt
440,02 ° C (beginnt sich jedoch ab 350 ° C zu zersetzen und stößt giftige Dämpfe aus).
Siedepunkt
537 ° C (explodiert).
Wasserlöslichkeit
312 g / 100 g Wasser bei 25 ° C..
Zerfließen
Seine Löslichkeit in Wasser ist so, dass es hygroskopisch ist; so sehr, dass es zerfließt und genug Feuchtigkeit aufnimmt, um sich aufzulösen. Diese Affinität zu Wasser kann auf die energetische Stabilität zurückzuführen sein, die K-Ionen gewinnen+ wenn hydratisiert, sowie eine niedrige Gitterenthalpie für KNO-Kristallezwei.
Kristalle können Wasser absorbieren, ohne sich zu einem Hydrat, KNO, aufzulösenzweiH.zweiO. Im Hydrat befindet sich das Wassermolekül, das die Ionen begleitet, wodurch die Kristallstruktur modifiziert wird.
Dieses Hydrat (oder mehrere von ihnen) kann unter -9 ° C gebildet werden; Bei höheren Temperaturen löst und hydratisiert das Wasser die Ionen und verformt den Kristall.
Löslichkeit in anderen Lösungsmitteln
In heißen Alkoholen schwer löslich und in Ammoniak sehr gut löslich.
pH
6-9. Seine wässrigen Lösungen sind daher alkalisch, da das Anion NOzwei- kann hydrolysiert werden.
Nomenklatur
Zum KNOzwei es kann auch auf andere Weise benannt werden. "Kaliumnitrit" entspricht dem Namen für dieses Salz gemäß der Stammnomenklatur; "Kaliumnitrit" gemäß der systematischen Nomenklatur, in der die einzige Wertigkeit von Kalium, +1, hervorgehoben ist; und Kaliumdioxonitrat (III) gemäß der systematischen Nomenklatur.
Der Name "Kaliumdioxonitrat (III)" hebt die + 3-Wertigkeit des Stickstoffatoms hervor. Obwohl es der von der IUPAC am meisten empfohlene Name für das KNO istzwei, 'Kaliumnitrit' ist nach wie vor am bequemsten und am einfachsten zu merken.
Erhalten
Der direkteste Weg zur Synthese, jedoch mit geringerer Ausbeute, ist die thermische Zersetzung von Kaliumnitrat oder Salpeter bei 400 ° C oder mehr:
2KNO3 => KNOzwei + ODERzwei
Teil des KNOzwei Es wird zusätzlich zu anderen gebildeten Produkten durch die Wärme zersetzt.
Eine andere Methode, um es mit einer höheren Ausbeute herzustellen oder zu synthetisieren, ist die Reduktion des KNO3 in Gegenwart von Blei, Kupfer oder Zink. Die Gleichung für diese Reaktion lautet wie folgt:
KNO3 + Pb => KNOzwei + PbO
Kaliumnitrat und Blei werden in einer Eisenpfanne stöchiometrisch gemischt, wo sie unter ständigem Rühren und Erhitzen für eine halbe Stunde schmelzen. Blei (II) oxid hat eine gelbe Farbe und die resultierende Masse wird heiß pulverisiert und mit kochendem Wasser behandelt. Dann wird die heiße Mischung filtriert.
Das heiße Filtrat wird fünf Minuten lang mit Kohlendioxid durchperlt, wodurch Bleicarbonat, PbCO, ausfällt3, unlöslich. Auf diese Weise wird das Blei vom Filtrat abgetrennt. Dem Filtrat wird verdünnte Salpetersäure zugesetzt, bis der pH-Wert neutral ist, es abkühlen gelassen wird und schließlich das Wasser verdampft wird, so dass sich die KNO-Kristalle bilden.zwei.
Anwendungen
Additiv und Reagenz
Kaliumnitrit wird als Zusatz zur Heilung von rotem Fleisch verwendet, wobei sein Geschmack und seine Farbe während der Lagerung länger erhalten bleiben und die Wirkung von Bakterien und bestimmten Toxinen wie Botulinum verzögert wird. Daher zeigt es eine antibakterielle Wirkung.
Der KNOzwei es oxidiert zu NO, das mit Myoglobin im Fleisch reagiert und folglich seine natürliche rote Farbe ändert. Später, wenn das Fleisch gekocht wird, erhält es seine charakteristische kräftige rosa Farbe.
Unter Bedingungen ohne Angabe des KNOzwei reagiert mit Fleischproteinen unter Bildung von Nitrosaminen, die krebserregend werden können.
Auf der anderen Seite der KNOzwei (obwohl vorzugsweise NaNOzwei) ist ein analytisches Reagenz, das bei der Synthese von Azofarbstoffen (der Reaktion von salpetriger Säure mit aromatischen Aminen) und bei der Analyse von Aminosäuren verwendet werden kann.
Gegenmittel
Während es seine negativen Auswirkungen hat, ist der KNOzwei wirkt als Gegenmittel bei Patienten, die mit Cyaniden und Schwefelwasserstoff vergiftet sind. Sein Mechanismus besteht in der Oxidation der Fe-Zentrenzwei+ zum Glauben3+ Von den Gruppen haben wir die Hämoglobine, die Methämoglobin produzieren, das dann mit den CN-Anionen reagiert- und HS-.
Ärzte
Im Magensaft des Magens ist das Anion NOzwei- Es wird zu NO reduziert, von dem bekannt ist, dass es eine vasodilatatorische Wirkung hat und die Durchblutung erhöht. In anderen Körperregionen, in denen der pH-Wert nicht sauer genug ist, sind einige Enzyme wie Xanthinoxidoreduktase für die Reduktion von NO verantwortlichzwei-.
KNO wurde verwendetzwei zur Behandlung von Krankheiten und Beschwerden wie Angina pectoris und Epilepsie (mit sehr negativen Nebenwirkungen).
Verweise
- Wikipedia. (2019). Kaliumnitrit. Wiederhergestellt von: en.wikipedia.org
- PrebChem. (2016). Herstellung von Kaliumnitrit. Wiederhergestellt von: prepchem.com
- Mark Gilchrist, Angela C. Shore und Nigel Benjamin. (2011). Anorganisches Nitrat und Nitrit und Kontrolle des Blutdrucks, Cardiovascular Research, Band 89, Ausgabe 3, 15. Februar 2011, Seiten 492-498, doi.org/10.1093/cvr/cvq309
- PubChem. (2019). Kaliumnitrit. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Chemische Formulierung. (2018). Kaliumnitrit. Wiederhergestellt von: formulacionquimica.com
- Nationales Zentrum zur Förderung der translationalen Wissenschaften. (2011). Kaliumnitrit. Wiederhergestellt von: drugs.ncats.io
- Richard J. Epley, Paul B. Addis und Joseph J. Warthesen. (1992). Nitrit im Fleisch. Universität von Minnesota.
- N. R. Rao, B. Prakash und M. Natarajan. (1975). Kristallstrukturumwandlungen in anorganischen Nitriten, Nitraten und Carbonaten. Institut für Chemie, Indian Institute of Technology, Kanpur, Indien.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.