
Charakteristische chemische Reaktionen, Teile, Typen, Beispiele

Das chemische Reaktionen Sie sind Veränderungen, die Materie in der Anordnung ihrer Atome erfährt, und sie finden statt, wenn zwei verschiedene Substanzen oder Verbindungen in Kontakt kommen. Änderungen entstehen im Prozess, die sofort sichtbar sind; wie ein Temperaturanstieg, Abkühlen, Gasbildung, Flashen oder Ausfällen eines Feststoffs.
Die häufigsten chemischen Reaktionen bleiben im Alltag oft unbemerkt; Tausende von ihnen werden in unserem Körper ausgeführt. Andere sind jedoch sichtbarer, da wir sie in der Küche herstellen können, indem wir die richtigen Utensilien und Zutaten auswählen. Zum Beispiel Backpulver mit Essig mischen, Zucker in Wasser schmelzen oder Purpurkohlsaft ansäuern.

In Laboratorien werden chemische Reaktionen immer häufiger. Alle kommen in Bechern oder Erlenmeyerkolben vor. Wenn sie etwas gemeinsam haben, ist keines von ihnen einfach, da sie Kollisionen, Verbindungsbrüche, Mechanismen, Verbindungsbildung, Energie und kinetische Aspekte verbergen..
Es gibt chemische Reaktionen, die so auffällig sind, dass Amateure und Wissenschaftler, die die Toxikologie von Reagenzien und einige Sicherheitsmaßnahmen kennen, diese in faszinierenden Demonstrationsereignissen in großem Maßstab reproduzieren..
Artikelverzeichnis
- 1 Konzept der chemischen Reaktion
- 2 Eigenschaften chemischer Reaktionen
- 2.1 Kinetik
- 2.2 Teigkonservierung
- 2.3 Physikalische Veränderungen und / oder Zustandsänderungen
- 2.4 Farbabweichung
- 2.5 Freisetzung von Gasen
- 2.6 Temperaturänderungen
- 3 Teile einer chemischen Reaktion
- 3.1 Reagenzien und Produkte
- 3.2 Reaktionsmedien
- 3.3 Gefäße oder Reaktoren
- 4 Arten chemischer Reaktionen
- 4.1 - Oxidationsreduktion (Redox)
- 4.2 - Synthese
- 4.3 - Zersetzung
- 4.4 - Verschiebung
- 4.5 - Gasbildung
- 4.6 - Metathese oder doppelte Verschiebung
- 5 Beispiele für chemische Reaktionen
- 5.1 Scrollen
- 5.2 Neutralisation
- 5.3 Doppeltes Scrollen
- 5.4 Redox
- 6 Gelöste chemische Reaktionsübungen
- 6.1 - Übung 1
- 6.2 - Übung 2
- 6.3 - Übung 3
- 7 Referenzen
Chemisches Reaktionskonzept
Chemische Reaktionen finden statt, wenn eine Bindung (ionisch oder kovalent) aufgebrochen wird, so dass an ihrer Stelle eine andere gebildet wird; Zwei Atome oder eine Reihe von Atomen interagieren nicht mehr stark, um neue Moleküle hervorzubringen. Dank dessen können die chemischen Eigenschaften einer Verbindung, ihre Reaktivität, Stabilität und Reaktionsfähigkeit bestimmt werden.
Sie sind nicht nur für die chemischen Reaktionen verantwortlich, die Materie ständig umwandelt, ohne ihre Atome zu beeinflussen, sondern erklären auch die Entstehung von Verbindungen, wie wir sie kennen..
Energie ist erforderlich, damit Bindungen brechen, und wenn Bindungen gebildet werden, wird sie freigesetzt. Wenn die absorbierte Energie größer als die freigesetzte ist, wird die Reaktion als endotherm bezeichnet; Wir haben eine Abkühlung der Umgebung. Wenn die freigesetzte Wärme höher ist als die absorbierte, handelt es sich um eine exotherme Reaktion. Die Umgebung wird heiß.
Eigenschaften chemischer Reaktionen

Kinetik
Theoretisch müssen die Moleküle miteinander kollidieren und genügend kinetische Energie mit sich führen, um das Aufbrechen einer Bindung zu fördern. Wenn ihre Kollisionen langsam oder ineffizient sind, wird die chemische Reaktion kinetisch beeinflusst. Dies kann entweder durch die physikalischen Zustände der Substanzen oder durch ihre Geometrie oder Struktur geschehen..
So wird Materie in einer Reaktion durch Absorbieren oder Abgeben von Wärme umgewandelt, während sie gleichzeitig Kollisionen erfährt, die die Bildung von Produkten begünstigen; die wichtigsten Bestandteile jeder chemischen Reaktion.
Konservierung von Teig
Aufgrund des Massenerhaltungsgesetzes bleibt die Gesamtmasse der Baugruppe nach einer chemischen Reaktion konstant. Somit ist die Summe der einzelnen Massen jeder Substanz gleich der Masse des erhaltenen Ergebnisses.
Körperliche Veränderungen und / oder Zustandsänderungen
Das Auftreten einer chemischen Reaktion kann mit einer Änderung des Zustands der Komponenten einhergehen; das heißt, eine Variation des festen, flüssigen oder gasförmigen Zustands des Materials.
Nicht alle Zustandsänderungen beinhalten jedoch eine chemische Reaktion. Zum Beispiel: Wenn Wasser aufgrund von Wärmeeinwirkung verdunstet, ist der nach dieser Zustandsänderung entstehende Wasserdampf immer noch Wasser.
Farbvariation
Unter den physikalischen Eigenschaften, die sich aus einer chemischen Reaktion ergeben, fällt die Änderung der Farbe der Reagenzien gegenüber der Farbe des Endprodukts auf..
Dieses Phänomen macht sich bei der Beobachtung der chemischen Reaktion von Metallen mit Sauerstoff bemerkbar: Wenn ein Metall oxidiert, ändert es seine charakteristische Farbe (je nach Fall Gold oder Silber), um einen rot-orangefarbenen Farbton zu erhalten, der als Rost bekannt ist..
Freisetzung von Gasen
Diese Eigenschaft manifestiert sich als Blasenbildung oder mit der Emission bestimmter Gerüche.
Im Allgemeinen treten Blasen als Folge der Einwirkung einer Flüssigkeit auf hohe Temperaturen auf, was zu einer Erhöhung der kinetischen Energie der Moleküle führt, die Teil der Reaktion sind..
Temperaturänderungen
Wenn Wärme ein Katalysator für die chemische Reaktion ist, wird im Endprodukt eine Temperaturänderung induziert. Daher kann der Ein- und Austritt von Wärme in den Prozess auch ein Merkmal chemischer Reaktionen sein..
Teile einer chemischen Reaktion
Reagenzien und Produkte
Jede chemische Reaktion wird durch eine Gleichung des Typs dargestellt:
A + B → C + D.
Wobei A und B die Reaktanten sind, während C und D die Produkte sind. Die Gleichung besagt, dass das Atom oder Molekül A mit B unter Bildung der Produkte C und D reagiert. Dies ist eine irreversible Reaktion, da die Reaktanten nicht wieder aus den Produkten stammen können. Andererseits ist die folgende Reaktion reversibel:
A + B. <=> C + D.
Es ist wichtig zu betonen, dass die Masse der Reaktanten (A + B) gleich der Masse der Produkte (C + D) sein muss. Andernfalls würde der Teig nicht konserviert. Ebenso muss die Anzahl der Atome für ein bestimmtes Element vor und nach dem Pfeil gleich sein.
Über dem Pfeil sind einige spezifische Spezifikationen der Reaktion angegeben: Temperatur (Δ), Einfall von ultravioletter Strahlung (hv) oder gebrauchter Katalysator.
Reaktionsmedien
In Bezug auf das Leben und die Reaktionen, die in unserem Körper auftreten, ist das Reaktionsmedium wässrig (ac). Chemische Reaktionen können jedoch in jedem flüssigen Medium (Ethanol, Eisessig, Toluol, Tetrahydrofuran usw.) stattfinden, solange die Reagenzien gut gelöst sind..
Gefäße oder Reaktoren
Kontrollierte chemische Reaktionen finden in einem Gefäß statt, entweder in einem einfachen Glas oder in einem Edelstahlreaktor.
Arten chemischer Reaktionen
Die Arten chemischer Reaktionen basieren auf dem, was auf molekularer Ebene geschieht. Welche Bindungen sind gebrochen und wie verbinden sich die Atome? Ebenso wird berücksichtigt, ob die Spezies Elektronen gewinnen oder verlieren; obwohl dies bei den meisten chemischen Reaktionen der Fall ist.
Hier erklären wir die verschiedenen Arten chemischer Reaktionen, die existieren.
- Oxidationsreduktion (Redox)
Kupferoxidation
Im Beispiel der Patina findet eine Oxidationsreaktion statt: Metallisches Kupfer verliert in Gegenwart von Sauerstoff Elektronen, um sich in das entsprechende Oxid umzuwandeln.
4Cu (s) + O.zwei(g) => CuzweiSie)
Kupfer (I) oxid oxidiert weiterhin zu Kupfer (II) oxid:
2CuzweiO (s) + O.zwei => 4CuO (s)
Diese Art der chemischen Reaktion, bei der die Spezies ihre Oxidationszahl (oder ihren Oxidationszustand) erhöht oder verringert, ist als Oxidations- und Reduktionsreaktion (Redoxreaktion) bekannt..
Metallisches Kupfer mit der Oxidationsstufe 0 verliert zuerst ein Elektron und dann das zweite (oxidiert), während Sauerstoff verbleibt (reduziert):
Cu => Cu+ + und-
Cu+ => Cuzwei+ + und-
ODERzwei + 2e- => 2Ozwei-
Der Gewinn oder Verlust von Elektronen kann durch Berechnung der Oxidationszahlen für die Atome in den chemischen Formeln ihrer resultierenden Verbindungen bestimmt werden..
Für CuzweiOder es ist bekannt, dass wir das Anion O haben, weil es ein Oxid istzwei-, Um die Ladungen neutral zu halten, muss daher jedes der beiden Kupferatome eine Ladung von +1 haben. Sehr ähnlich passiert mit CuO.
Wenn Kupfer oxidiert, erhält es positive Oxidationszahlen; und zu reduzierender Sauerstoff negative Oxidationszahlen.
Eisen und Kobalt
Zusätzliche Beispiele für Redoxreaktionen sind unten gezeigt. Außerdem wird ein kurzer Kommentar abgegeben und die Änderungen der Oxidationszahlen angegeben..
FeClzwei + CoCl3 => FeCl3 + CoClzwei
Wenn die Oxidationszahlen berechnet werden, wird angemerkt, dass diejenigen von Cl mit einem konstanten Wert von -1 bleiben; nicht so, mit denen von Fe y Co..
Auf den ersten Blick wurde Eisen oxidiert und Kobalt reduziert. Woher weißt du das? Weil Eisen jetzt nicht mit zwei Cl-Anionen interagiert- Bei drei ist das Chloratom (neutral) elektronegativer als Eisen und Kobalt. Auf der anderen Seite passiert das Gegenteil mit Kobalt: Es geht von der Interaktion mit drei Cl aus- zwei von ihnen.
Wenn die obige Argumentation nicht klar ist, schreiben wir die chemischen Gleichungen des Nettotransfers von Elektronen:
Vertrauenzwei+ => Glaube3+ + und-
Co.3+ + und- => Co.zwei+
Daher ist das Fezwei+ rostet, während Co.3+ ist reduziert.
Jod und Mangan
6KMnO4 + 5KI + 18HCl => 6MnClzwei + 5KIO3 + 6KCl + 9HzweiODER
Die obige chemische Gleichung mag kompliziert erscheinen, ist es aber nicht. Chlor (Cl-) oder Sauerstoff (O.zwei-) erleben Gewinn oder Verlust ihrer Elektronen. Jod und Mangan, ja.
Wenn wir nur die Verbindungen mit Jod und Mangan betrachten, haben wir:
KI => KIO3 (Oxidationszahl: -1 bis +5, sechs Elektronen verlieren)
KMnO4 => MnClzwei (Oxidationszahl: +7 bis +2, fünf Elektronen gewinnen)
Jod wird oxidiert, während Mangan reduziert wird. Wie kann man es wissen, ohne Berechnungen durchzuführen? Weil Jod von Kalium zu Wechselwirkung mit drei Sauerstoffatomen übergeht (elektronegativer); und Mangan seinerseits verliert Wechselwirkungen mit Sauerstoff, um mit Chlor zu sein (weniger elektronegativ).
KI kann nicht sechs Elektronen verlieren, wenn KMnO4 gewinne fünf; Deshalb muss die Anzahl der Elektronen in der Gleichung ausgeglichen werden:
5 (KI => KIO3 + 6e-)
6 (KMnO4 + 5e- => MnClzwei)
Dies führt zu einem Nettotransfer von 30 Elektronen.
Verbrennung
Die Verbrennung ist eine heftige und energetische Oxidation, bei der Licht und Wärme freigesetzt werden. Im Allgemeinen ist bei dieser Art der chemischen Reaktion Sauerstoff als Oxidations- oder Oxidationsmittel beteiligt; während das Reduktionsmittel der Kraftstoff ist, der am Ende des Tages verbrennt.
Wo Asche ist, war Verbrennung. Diese bestehen im wesentlichen aus Kohlenstoff und Metalloxiden; obwohl seine Zusammensetzung logischerweise davon abhängt, was der Kraftstoff war. Nachfolgend einige Beispiele:
C (s) + O.zwei(g) => COzwei(G)
2CO (g) + O.zwei(g) => 2COzwei(G)
C.3H.8(g) + 50zwei(g) => 3COzwei(g) + 4HzweiO (g)
Jede dieser Gleichungen entspricht vollständigen Verbrennungen; Das heißt, der gesamte Kraftstoff reagiert mit einem Überschuss an Sauerstoff, um seine vollständige Umwandlung zu gewährleisten.
Ebenso ist zu beachten, dass COzwei und H.zweiOder sind die Hauptprodukte gasförmig, wenn kohlenstoffhaltige Körper verbrennen (wie Holz, Kohlenwasserstoffe und tierische Gewebe). Es ist unvermeidlich, dass aufgrund von Sauerstoffmangel sowie weniger sauerstoffhaltigen Gasen wie CO und NO etwas Kohlenstoff-Allotrop gebildet wird.
- Synthese
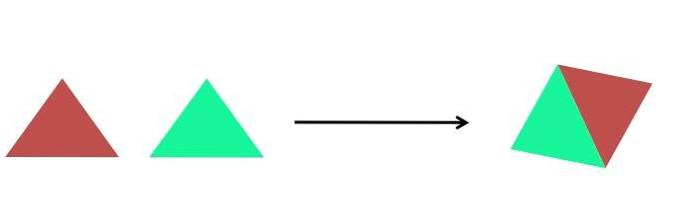
Das Bild oben zeigt eine äußerst einfache Darstellung. Jedes Dreieck ist eine Verbindung oder ein Atom, die sich zu einer einzigen Verbindung verbinden. Zwei Dreiecke bilden ein Parallelogramm. Die Massen nehmen zu und die physikalischen und chemischen Eigenschaften des Produkts unterscheiden sich oft stark von denen seiner Reagenzien.
Beispielsweise erzeugt die Verbrennung von Wasserstoff (die auch eine Redoxreaktion ist) Wasserstoffoxid oder Sauerstoffhydrid; besser bekannt als Wasser:
H.zwei(g) + O.zwei(g) => 2HzweiO (g)
Wenn die beiden Gase bei hoher Temperatur gemischt werden, verbrennen sie unter Bildung von gasförmigem Wasser. Wenn die Temperaturen abkühlen, kondensieren die Dämpfe zu flüssigem Wasser. Mehrere Autoren betrachten diese Synthesereaktion als eine der möglichen Alternativen, um fossile Brennstoffe bei der Energiegewinnung zu ersetzen.
Die H-H- und O = O-Bindungen brechen und bilden zwei neue Einfachbindungen: H-O-H. Wasser ist bekanntlich eine einzigartige Substanz (jenseits des romantischen Sinns), und seine Eigenschaften unterscheiden sich stark von gasförmigem Wasserstoff und Sauerstoff..
Ionische Verbindungen
Die Bildung ionischer Verbindungen aus ihren Elementen ist auch ein Beispiel für eine Synthesereaktion. Eine der einfachsten ist die Bildung von Metallhalogeniden der Gruppen 1 und 2. Zum Beispiel die Synthese von Calciumbromid:
Ca (s) + Brzwei(l) => CaBrzwei(s)
Eine allgemeine Gleichung für diese Art der Synthese lautet:
M (s) + X.zwei => MXzwei(s)
Koordinierung
Wenn die gebildete Verbindung ein Metallatom innerhalb einer elektronischen Geometrie beinhaltet, wird gesagt, dass es sich um einen Komplex handelt. In Komplexen bleiben Metalle durch schwache kovalente Bindungen an Liganden gebunden und werden durch Koordinationsreaktionen gebildet.
Zum Beispiel haben wir den Komplex [Cr (NH3)6]]3+. Dies entsteht, wenn das Kation Cr3+ ist in Gegenwart der Ammoniakmoleküle NH3, die als Chromliganden wirken:
Cr3+ + 6NH3 => [Cr (NH3)6]]3+
Das resultierende Koordinationsoktaeder um das Chrommetallzentrum ist unten gezeigt:
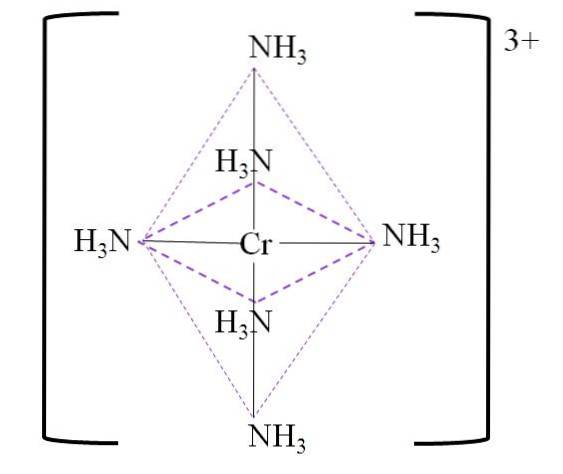
Beachten Sie, dass die 3+ -Ladung auf Chrom im Komplex nicht neutralisiert wird. Seine Farbe ist lila, und deshalb wird das Oktaeder mit dieser Farbe dargestellt.
Einige Komplexe sind interessanter, wie im Fall bestimmter Enzyme, die Eisen-, Zink- und Calciumatome koordinieren.
- Zersetzung
Die Zersetzung ist das Gegenteil der Synthese: Eine Verbindung zerfällt in ein, zwei oder drei Elemente oder Verbindungen.
Zum Beispiel haben wir die folgenden drei Zerlegungen:
2HgO (s) => 2Hg (1) + O.zwei(G)
2HzweiODERzwei(l) => 2HzweiO (l) + O.zwei(G)
H.zweiCO3(ac) => COzwei(g) + H.zweiO (l)
HgO ist ein rötlicher Feststoff, der sich unter Hitzeeinwirkung in metallisches Quecksilber, eine schwarze Flüssigkeit und Sauerstoff zersetzt..
Wasserstoffperoxid oder Wasserstoffperoxid zersetzen sich und ergeben flüssiges Wasser und Sauerstoff.
Und Kohlensäure zerfällt ihrerseits in Kohlendioxid und flüssiges Wasser.
Eine "trockenere" Zersetzung ist die, unter der metallische Carbonate leiden:
Dieb3(s) => CaO (s) + COzwei(G)
Klasse Vulkan

Eine Zersetzungsreaktion, die im Chemieunterricht verwendet wurde, ist die thermische Zersetzung von Ammoniumdichromat (NH)4)zweiCrzweiODER7. Dieses krebserregende Orangensalz (daher muss es mit großer Sorgfalt behandelt werden) verbrennt, um viel Wärme freizusetzen und einen grünen Feststoff, Chromoxid, Cr, zu erzeugenzweiODER3::
(NH4)zweiCrzweiODER7(s) => CrzweiODER3(s) + 4HzweiO (g) + N.zwei(G)
- Verschiebung
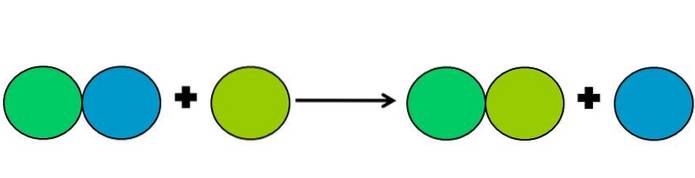
Verdrängungsreaktionen sind eine Art von Redoxreaktion, bei der ein Element ein anderes in einer Verbindung verdrängt. Das verschobene Element reduziert oder gewinnt Elektronen.
Um dies zu vereinfachen, wird das obige Bild gezeigt. Die Kreise repräsentieren ein Element. Es wird beobachtet, dass der hellgrüne Kreis den blauen Kreis verdrängt und außen verbleibt; aber nicht nur das, sondern der blaue Kreis schrumpft dabei und der hellgrüne rostet.
Von Wasserstoff
Zum Beispiel haben wir die folgenden chemischen Gleichungen, um die oben erläuterten aufzudecken:
2Al (s) + 6HCl (aq) => AlCl3(aq) + 3Hzwei(G)
Zr (s) + 2HzweiO (g) => ZrOzwei(s) + 2Hzwei(G)
Zn (s) + H.zweiSW4(ac) => ZnSO4(ac) + H.zwei(G)
Was ist das verdrängte Element für diese drei chemischen Reaktionen? Wasserstoff, der zu molekularem Wasserstoff reduziert wird, H.zwei;; es geht von einer Oxidationszahl von +1 bis 0. Beachten Sie, dass die Metalle Aluminium, Zirkonium und Zink die Wasserstoffatome von Säuren und Wasser verdrängen können; während Kupfer, weder Silber noch Gold, dies nicht kann.
Von Metallen und Halogenen
Ebenso gibt es diese zwei zusätzlichen Verdrängungsreaktionen:
Zn (s) + CuSO4(ac) => Cu (s) + ZnSO4(ac)
Clzwei(g) + 2NaI (aq) => 2NaCl (aq) + I.zwei(s)
In der ersten Reaktion verdrängt Zink das weniger aktive Metall Kupfer; Zink wird oxidiert, während Kupfer reduziert wird.
Bei der zweiten Reaktion verdrängt andererseits Chlor, ein Element, das reaktiver als Jod ist, das letztere im Natriumsalz. Hier ist es umgekehrt: Das reaktivste Element wird durch Oxidation des verdrängten Elements reduziert; Daher wird Chlor durch Oxidation von Jod reduziert.
- Gasbildung
Bei den Reaktionen konnte festgestellt werden, dass mehrere von ihnen Gase erzeugten und daher auch in diese Art der chemischen Reaktion eintraten. Ebenso werden die Reaktionen des vorherigen Abschnitts, die der Wasserstoffverdrängung durch ein aktives Metall, als Gasbildungsreaktionen betrachtet..
Zusätzlich zu den bereits erwähnten setzen Metallsulfide beispielsweise Schwefelwasserstoff frei (der nach faulen Eiern riecht), wenn Salzsäure zugesetzt wird:
N / AzweiS (s) + 2HCl (aq) => 2NaCl (aq) + H.zweiS (g)
- Metathese oder doppelte Verschiebung
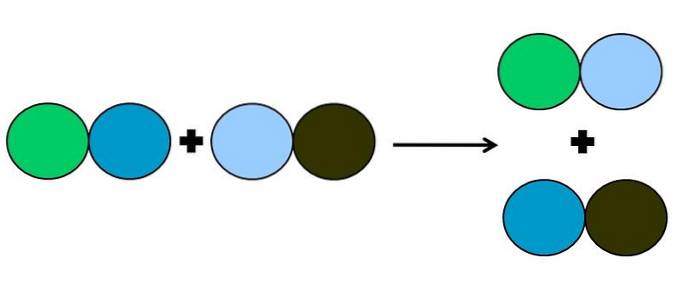
Bei der Metathese oder Doppelverdrängungsreaktion kommt es zu einem Partnerwechsel ohne Elektronentransfer. Das heißt, es wird nicht als Redoxreaktion angesehen. Wie im obigen Bild zu sehen ist, unterbricht der grüne Kreis die Verbindung mit dem dunkelblauen Kreis, um eine Verbindung zum hellblauen Kreis herzustellen.
Niederschlag
Wenn die Wechselwirkungen eines der Partner stark genug sind, um den Solvatationseffekt der Flüssigkeit zu überwinden, wird ein Niederschlag erhalten. Die folgenden chemischen Gleichungen repräsentieren Fällungsreaktionen:
AgNO3(aq) + NaCl (aq) => AgCl (s) + NaNO3(ac)
CaClzwei(ac) + NazweiCO3(ac) => CaCO3(s) + 2NaCl (aq)
In der ersten Reaktion wurde das Cl- wechselt zu NO3- unter Bildung von Silberchlorid, AgCl, das ein weißer Niederschlag ist. Und in der zweiten Reaktion das CO3zwei- wechselt zu Cl- Calciumcarbonat auszufällen.
Basensäure
Die vielleicht symbolträchtigste der Metathesereaktionen ist die Säure-Base-Neutralisation. Schließlich werden zwei Säure-Base-Reaktionen als Beispiele gezeigt:
HCl (aq) + NaOH (aq) => NaCl (aq) + H.zweiO (l)
2HCl (aq) + Ba (OH)zwei(ac) => BaClzwei(aq) + 2HzweiO (l)
Das OH- Verdrängen Sie die Cl- Wasser und Chloridsalze zu bilden.
Beispiele für chemische Reaktionen
Im Folgenden und unten werden einige chemische Reaktionen mit ihren jeweiligen Gleichungen und Kommentaren erwähnt..
Verschiebung
Zn (s) + AgNO3(ac) → 2Ag (s) + Zn (NO3)zwei(ac)
Zink verdrängt Silber in seinem Nitratsalz: reduziert es von Ag+ Infolgedessen beginnt metallisches Silber im Medium auszufallen, was unter dem Mikroskop als silberne Bäume ohne Blätter beobachtet wird. Andererseits verbindet sich Nitrat mit Zn-Ionenzwei+ was zur Bildung von Zinknitrat führt.
Neutralisation
Dieb3(s) + 2HCl (aq) → CaClzwei(ac) + H.zweiO (l) + COzwei(G)
Salzsäure neutralisiert das Calciumcarbonatsalz unter Bildung von Salz, Calciumchlorid, Wasser und Kohlendioxid. Der COzwei es sprudelt und wird im Wasser erkannt. Dieses Sprudeln wird auch durch Zugabe von HCl zu Kreide- oder Eierschalen erhalten, die reich an CaCO sind3.
NH3(g) + HCl (g) → NH4Cl (s)
Bei dieser zweiten Reaktion neutralisieren die HCl-Dämpfe das gasförmige Ammoniak. Das Ammoniumchloridsalz NH4Cl entsteht als weißlicher Rauch (unteres Bild), da es sehr feine Partikel enthält, die in der Luft schweben.

Doppelte Schriftrolle
AgNO3(aq) + NaCl (aq) → AgCl (s) + NaNO3(ac)
Bei einer Doppelverdrängungsreaktion findet ein Austausch von "Partnern" statt. Silber wechselt die Partner mit Natrium. Das Ergebnis ist, dass das neue Salz, Silberchlorid, AgCl, als milchiger Feststoff ausfällt..
Redox

Es gibt unzählige Redoxreaktionen. Eines der beeindruckendsten ist das von Barkin Dog:
8 N.zweiO (g) + 4 CSzwei(l) → S.8(s) + 4 COzwei(g) + 8 N.zwei(G)
Die Energie, die bei der Bildung der drei stabilen Produkte freigesetzt wird, ist so groß, dass es zu einem bläulichen Blitz (oberes Bild) und einem starken Druckanstieg kommt, der durch die entstehenden Gase (CO) verursacht wirdzwei und N.zwei).
Und all dies wird von einem sehr lauten Geräusch begleitet, das dem Bellen eines Hundes ähnelt. Der erzeugte Schwefel, S.8, beschichtet die Innenwände der Röhre gelb.
Welche Art wird reduziert und welche oxidiert? In der Regel haben die Elemente die Oxidationszahl 0. Daher müssen Schwefel und Stickstoff in den Produkten die Spezies sein, die Elektronen gewonnen oder verloren haben..
Schwefel oxidierte (verlorene Elektronen), da er die Oxidationszahl -2 in CS hattezwei (C.4+S.zweizwei-):
S.zwei- → S.0 + 2e-
Während Stickstoff reduziert wurde (gewonnene Elektronen), weil es Oxidationszahl +1 im N hattezweiAUFzwei+ODERzwei-):
2N+ + 2e → N.0
Gelöste chemische Reaktionsübungen
- Übung 1
Welches Salz fällt bei der folgenden Reaktion in wässrigem Medium aus?
N / AzweiS (ac) + FeSO4(ac) → ¿?
In der Regel fallen alle Sulfide mit Ausnahme der mit Alkalimetallen und Ammonium gebildeten in wässrigem Medium aus. Eine doppelte Verdrängung tritt auf: Eisen bindet an Schwefel und Natrium an Sulfat:
N / AzweiS (ac) + FeSO4(ac) → FeS (s) + NazweiSW4(ac)
- Übung 2
Welche Produkte erhalten wir aus der folgenden Reaktion??
Stempel3)zwei + Ca (OH)zwei →?
Calciumhydroxid ist in Wasser nicht sehr löslich; Die Zugabe von Kupfernitrat hilft jedoch, es zu solubilisieren, da es unter Bildung seines entsprechenden Hydroxids reagiert:
Stempel3)zwei(ac) + Ca (OH)zwei(ac) → Cu (OH)zwei(s) + Ca (NO3)zwei(ac)
Cu (OH)zwei sofort als blauer Niederschlag erkennbar.
- Übung 3
Welches Salz wird in der folgenden Neutralisationsreaktion erzeugt?
Al (OH)3(s) + 3HCl (aq) → ¿?
Aluminiumhydroxid verhält sich wie eine Base, die mit Salzsäure reagiert. Bei einer Säure-Base-Neutralisationsreaktion (Bronsted-Lowry) wird immer Wasser gebildet, daher muss das andere Produkt Aluminiumchlorid, AlCl, sein3::
Al (OH)3(s) + 3HCl (aq) → AlCl3(aq) + 3HzweiODER
Diesmal ist das AlCl3 fällt nicht aus, da es sich um ein (teilweise) wasserlösliches Salz handelt.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). CENGAGE Lernen.
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Ana Zita. (18. November 2019). Chemische Reaktionen. Wiederhergestellt von: todamateria.com
- Kashyap Vyas. (23. Januar 2018). 19 Coole chemische Reaktionen, die beweisen, dass die Wissenschaft faszinierend ist. Wiederhergestellt von: Interestingengineering.com
- BeautifulChemistry.net (s.f.). Reaktion. Wiederhergestellt von: beautifulchemistry.net
- Wikipedia. (2019). Chemische Reaktion. Wiederhergestellt von: en.wikipedia.org



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.