
Struktur, Eigenschaften, Verwendungen von Magnesiumnitrat (Mg (NO3) 2)

Das Magnesiumnitrat ist ein anorganischer Feststoff, dessen chemische Formel Mg (NO3)zwei. Es ist eine ionische Verbindung, die durch Vereinigung eines Magnesiumkations Mg gebildet wirdzwei+ und zwei Nitratanionen NR3-.
Mg (NO3)zwei es ist ein weißer kristalliner Feststoff. Es ist sehr hygroskopisch, dh es nimmt leicht Wasser aus der Umwelt auf. Wenn es in Kontakt mit der Umgebungsluft bleibt, neigt es dazu, sein Mg-Hexahydrat (NO3)zwei•6HzweiODER.

Magnesiumnitrat Hexahydrat Mg (NR3)zwei•6HzweiO hat in seiner kristallinen Struktur 6 Moleküle Wasser H.zweiOder für jedes Mg-Molekül (NO3)zwei. Magnesiumnitrat kommt in Höhlen und Minen in Form des Minerals Nitromagnesit vor.
Mg (NO3)zwei kommerziell erhalten durch Umsetzen von Magnesiummetall Mg mit Salpetersäure HNO3.
Es hat eine Vielzahl von Verwendungsmöglichkeiten, beispielsweise in der Landwirtschaft als Dünger, da es Nährstoffe für Pflanzen wie Stickstoff (N) und Magnesium (Mg) liefert..
Es wird in der Feuerwerks- oder pyrotechnischen Industrie sowie zur Gewinnung von konzentrierter Salpetersäure eingesetzt. Wird in chemischen Analysen, physikalischen Experimenten sowie medizinischen und wissenschaftlichen Studien verwendet.
Artikelverzeichnis
- 1 Struktur
- 2 Nomenklatur
- 3 Eigenschaften
- 3.1 Physikalischer Zustand
- 3.2 Molekulargewicht
- 3.3 Schmelzpunkt
- 3.4 Siedepunkt
- 3.5 Dichte
- 3.6 Löslichkeit
- 3.7 Wirkung der Erwärmung
- 4 Erhalten
- 4.1 Lage in der Natur
- 5 Verwendungen
- 5.1 In neueren Studien
- 5.2 In Krankheitsstudien
- 6 Referenzen
Struktur
Wasserfreies Magnesiumnitrat besteht aus einem Magnesiumkation Mgzwei+ und zwei Nitratanionen NR3-.
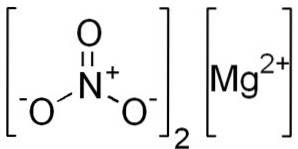
Magnesiumion Mgzwei+ besitzt Elektronenkonfiguration: 1szwei, 2szwei 2 P.6, 3s0, da es die zwei Elektronen der äußersten Schale (3s) ergeben hat. Diese Konformation ist sehr stabil.
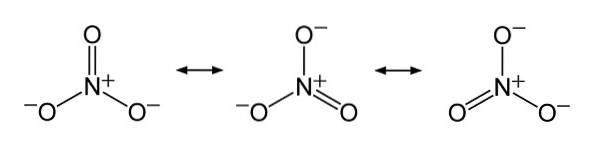
Das NO-Ion3- hat eine flache und symmetrische Struktur.
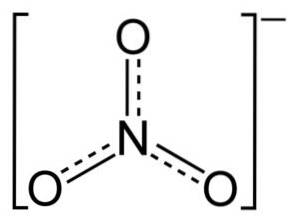
In der Struktur von NO3- Die negative Ladung wird kontinuierlich auf die drei Sauerstoffatome verteilt.
Nomenklatur
-Wasserfreies Magnesiumnitrat: Mg (NO3)zwei
-Magnesiumnitratdihydrat: Mg (NO3)zwei•2HzweiODER
-Magnesiumnitrathexahydrat: Mg (NO3)zwei•6HzweiODER
-Magnesiumdinitrat
Eigenschaften
Körperlicher Status
-Mg (NO3)zwei wasserfrei: weißer Feststoff, kubische Kristalle.
-Mg (NO3)zwei Dihydrat: weißer kristalliner Feststoff.
-Mg (NO3)zwei Hexahydrat: farblose feste, monokline Kristalle
Molekulargewicht
-Mg (NO3)zwei wasserfrei: 148,31 g / mol
-Mg (NO3)zwei Hexahydrat: 256,41 g / mol
Schmelzpunkt
-Mg (NO3)zwei Hexahydrat: 88,9 ºC
Siedepunkt
-Mg (NO3)zwei Hexahydrat: kocht nicht, zersetzt sich bei 330 ºC
Dichte
-Mg (NO3)zwei wasserfrei: 2,32 g / cm3
-Mg (NO3)zwei Dihydrat: 1,456 g / cm3
-Mg (NO3)zwei Hexahydrat: 1.464 g / cm3
Löslichkeit
Wasserfreies Magnesiumnitrat ist in Wasser sehr gut löslich: 62,1 g / 100 ml bei 0 ° C; 69,5 g / 100 ml bei 20 ° C. Es ist auch sehr hygroskopisch, da es bei Kontakt mit Luft schnell das Hexahydrat bildet.
Mg (NO3)zwei Dihydrat ist auch in Wasser und Ethanol sehr gut löslich. Es ist hygroskopisch.
Mg (NO3)zwei Hexahydrat ist auch in Wasser sehr gut löslich. Es ist in Ethanol mäßig löslich. Es ist das stabilste der drei, die mit Luft in Kontakt kommen, dh von den dreien ist es dasjenige, das am wenigsten Wasser aus der Umwelt aufnimmt.
Heizwirkung
Durch Einbringen einer wässrigen Lösung von Mg (NO3)zwei Beim Verdampfen von Wasser kristallisiert das Salz das Hexahydrat: Mg (NO3)zwei•6HzweiO. Hexahydrat bedeutet, dass im Feststoff jedes Molekül Mg (NO3)zwei ist an 6 Wassermoleküle gebunden.
Es gibt auch das Dihydrat Mg (NO3)zwei•2HzweiOder in welchem Mg (NO3)zwei Feststoff ist an 2 Wassermoleküle gebunden.
Erhitzen von Mg-Hexahydrat (NR3)zwei•6HzweiOder das wasserfreie Salz wird nicht erhalten, da Magnesiumnitrat eine hohe Affinität zu Wasser aufweist.
Aus diesem Grund bildet es beim Erhitzen über seinen Schmelzpunkt zunächst ein gemischtes Salz aus Magnesiumnitrat und Hydroxid Mg (NO3)zwei•4 mg (OH)zwei.
Dieses gemischte Salz zersetzt sich bei Erreichen von 400 ºC zu Magnesiumoxid MgO und es werden Stickoxidgase freigesetzt..
Erhalten
Es kann durch Umsetzen von Magnesiumcarbonat MgCO hergestellt werden3 mit Salpetersäure HNO3, Kohlendioxid CO abgebenzwei::
MgCO3 + 2 HNO3 → Mg (NO3)zwei + COzwei↑ + H.zweiODER
Es kann auch mit Magnesiumhydroxid Mg (OH) erhalten werden.zwei und Salpetersäure:
Mg (OH)zwei + 2 HNO3 → Mg (NO3)zwei + 2 hzweiODER
Kommerziell wird es auf verschiedene Arten erhalten:
1- Umsetzung des Magnesiummetalls Mg mit Salpetersäure HNO3.
2- Durch Umsetzung von Magnesiumoxid MgO mit Salpetersäure HNO3.
3- Bindendes Magnesiumhydroxid Mg (OH)zwei und Ammoniumnitrat NH4NICHT3, Bildung des Magnesiumnitrats unter Entwicklung von Ammoniak NH3.
Lage in der Natur
Mg (NO3)zwei Hexahydrat kommt auf natürliche Weise in Minen und Höhlen oder Höhlen in Form des Minerals Nitromagnesit vor.
Dieses Mineral ist vorhanden, wenn Guano mit magnesiumreichen Gesteinen in Kontakt kommt. Guano ist das Material, das aus den Exkrementen von Seevögeln und Robben in sehr trockenen Umgebungen entsteht..
Anwendungen
Mg (NO3)zwei Hexahydrat wird in der Keramik-, Chemie- und Agrarindustrie eingesetzt.
Diese Verbindung ist ein Dünger, weil sie Stickstoff (N) liefert, eines der drei Grundelemente, die von Pflanzen benötigt werden, und Magnesium (Mg), eine sekundäre Komponente, die auch für Pflanzen wichtig ist..
Auf diese Weise wird es mit anderen Zutaten in Gewächshäusern und im Hydrokulturanbau verwendet. Letzteres besteht darin, die Pflanzen in einer wässrigen Lösung mit Düngersalzen anstelle von Erde zu züchten.

Es wird auch als Katalysator bei der Gewinnung petrochemischer Verbindungen verwendet. Es ermöglicht die Einstellung der Viskosität in bestimmten Prozessen. Wasserfreies Magnesiumnitrat wird in der Pyrotechnik, dh zur Herstellung von Feuerwerkskörpern, verwendet.

Wasserfreies Magnesiumnitrat ist ein Dehydratisierungsmittel. Es wird zum Beispiel verwendet, um konzentrierte Salpetersäure zu erhalten, da es Wasser eliminiert und Säuredämpfe bis zu 90-95% HNO konzentriert3.

Es wird auch verwendet, um Ammoniumnitrat zu beschichten und die Bildung von Perlen dieses komprimierten Materials zu ermöglichen..
Es ist nützlich bei der Formulierung von Tinten, Toner (Schwarzpulver, das in Fotokopiersystemen verwendet wird) und Farbprodukten. Dient als Magnesiumstandard in der analytischen Chemie.
Das Salz von Magnesiumnitrat und Cer Mg (NO3)zwei•Stirnrunzeln3)3 Es ist für physikalische Experimente bei niedrigen Temperaturen von Interesse, da es als Kühlmittel in adiabatischen Entmagnetisierungsexperimenten (ohne Wärmeübertragung) verwendet wird..
Dieses Magnesium- und Cer-Salz wurde verwendet, um extrem niedrige Temperaturen auf der Kelvin-Skala (nahe dem absoluten Nullpunkt) zu erreichen..
In neueren Studien
Mehrere Forscher haben Mg (NO3)zwei in Zusammensetzungen mit synthetischen und natürlichen Polymeren zur Erhöhung der Leitfähigkeit in Magnesiumionenbatterien.
Es wurde auch beim Bau von Superkondensatoren zur Speicherung von Hochleistungsenergie untersucht.
In Krankheitsstudien
Magnesiumnitrat wurde Laborratten mit arterieller Hypertonie (Hochdruck) verabreicht und es wurde festgestellt, dass es den Blutdruck wirksam senkt und die Auswirkungen von Komplikationen dieser Krankheit abschwächt oder mildert.
Es hat auch Schutzwirkungen gegen neurologische Störungen (neuronale Störung) und gegen den Tod bei Ratten während Verstopfungsprozessen der Halsschlagader gezeigt..
Verweise
- Qian, M. et al. (2018). Außergewöhnliche poröse Wenigschichtkohlenstoffe mit hoher Kapazität aus der Pechini-Verbrennung von Magnesiumnitratgel. ACS Appl Mater Interfaces 2018, 10 (1): 381 & ndash; 388. Von ncbi.nlm.nih.gov wiederhergestellt.
- Manjuladevi, R. et al. (2018). Eine Studie über Mischpolymerelektrolyte auf Basis von Poly (vynilalkohol) -Poly (acrylnitril) mit Magnesiumnitrat für Magnesiumbatterien. Ionics (2018) 24: 3493. Von link.springer.com wiederhergestellt.
- Kiruthika, S. et al. (2019). Umweltfreundlicher Biopolymerelektrolyt, Pektin mit Magnesiumnitrat-Salz, zur Anwendung in elektrochemischen Geräten. J Solid State Electrochem (2019) 23: 2181. Wiederhergestellt von link.springer.com.
- Vilskerts R. et al. (2014). Magnesiumnitrat mildert den Blutdruckanstieg bei SHR-Ratten. Magnes Res 2014, 27 (1): 16 & ndash; 24. Von ncbi.nlm.nih.gov wiederhergestellt.
- Kuzenkov V.S. und Krushinskii A.L. (2014). Schutzwirkung von Magnesiumnitrat gegen neurologische Störungen, die durch zerebrale Ischämie bei Ratten hervorgerufen werden. Bull Exp Biol Med 2014, 157 (6): 721 & ndash; 3. Von ncbi.nlm.nih.gov wiederhergestellt.
- Ropp, R.C. (2013). Erdalkaliverbindungen der Gruppe 15 (N, P, As, Sb und Bi). Magnesiumnitrat. In der Enzyklopädie der Erdalkaliverbindungen. Von sciencedirect.com wiederhergestellt.
- Kirk-Othmer (1994). Enzyklopädie der chemischen Technologie. Band 1. Vierte Ausgabe. John Wiley & Sons.
- UNS. Nationalbibliothek für Medizin. (2019). Magnesiumnitrat. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov.

Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.