
Myofilamenttypen, Struktur und Organisation
Das Myofilamente sind die kontraktilen Proteine von Myofibrillen, die die Struktureinheiten von Muskelzellen sind, längliche Zellen, die Muskelfasern genannt werden.
Muskelfasern und ihre Bestandteile haben bestimmte Namen. Beispielsweise sind die Membran, das Zytoplasma, die Mitochondrien und das endoplasmatische Retikulum als Sarkolemma, Sarkoplasma, Sarkosomen bzw. sarkoplasmatisches Retikulum bekannt..
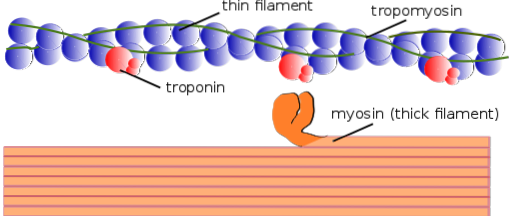
In gleicher Weise werden die kontraktilen Elemente im Inneren gemeinsam als Myofibrillen bezeichnet. und die kontraktilen Proteine, aus denen Myofibrillen bestehen, werden Myofilamente genannt.
Es gibt zwei Arten von Myofilamenten: dünn und dick. Die dünnen Filamente bestehen hauptsächlich aus drei Proteinen: F-Actin, Tropomyosin und Troponin. Die dicken Filamente bestehen unterdessen ausschließlich aus einem anderen Protein, das als Myosin II bekannt ist.
Zusätzlich zu diesen gibt es andere Proteine, die sowohl mit dicken als auch mit dünnen Filamenten assoziiert sind, aber diese haben keine kontraktilen Funktionen, sondern eher strukturelle, darunter, um nur einige zu nennen, Titin und Nebel.
Artikelverzeichnis
- 1 Arten von Muskelfasern
- 2 Struktur
- 2.1 Dünne Myofilamente
- 2.2 Dicke Myofilamente
- 3 Organisation
- 3.1 Wie sind Myofilamente in Sarkomeren organisiert??
- 4 Kontraktionsmechanismus
- 5 Referenzen
Arten von Muskelfasern
Die besondere Anordnung der Myofilamente, aus denen die Myofibrillen bestehen, führt zu zwei Arten von Muskelfasern: gestreifte Muskelfasern und glatte Muskelfasern.
Gestreifte Muskelfasern zeigen bei der Untersuchung unter einem Lichtmikroskop ein Muster von Streifen oder Querbändern, die sich auf ihrer gesamten Oberfläche wiederholen und dem Muskel, der sie enthält, den Namen eines gestreiften Muskels geben. Es gibt zwei Arten von gestreiften Muskelfasern, Skelett- und Herzfasern.
Muskelfasern, die dieses Muster von Querbändern nicht zeigen, werden glatte Fasern genannt. Sie sind diejenigen, die die Muskeln der Gefäßwände und der Eingeweide bilden.
Struktur
Dünne Myofilamente
Diese Myofilamente bestehen aus F-Actin und zwei assoziierten Proteinen: Tropomyosin und Troponin, die regulatorische Funktionen haben..
F-Actin oder filamentöses Actin ist ein Polymer eines anderen kleineren globulären Proteins, das als G-Actin oder globulares Actin bezeichnet wird und ein Molekulargewicht von etwa 42 kDa aufweist. Es hat eine Bindungsstelle für Myosin und ist durch Bildung von zwei Ketten angeordnet, die als Doppelhelix angeordnet sind und aus ungefähr 13 Monomeren pro Umdrehung bestehen..
F-Actin-Filamente zeichnen sich durch zwei Pole aus: einen positiven, der auf die Z-Scheibe gerichtet ist, und einen negativen, der zur Mitte des Sarkomers hin angeordnet ist.
Tropomyosin besteht auch aus einer Doppelhelix-Polypeptid-Doppelkette. Es ist ein 64-kDa-Protein, das Filamente bildet, die sich in den Rillen befinden, die die Doppelhelixketten der dünnen F-Actin-Filamente hinterlassen, als ob sie die leeren Räume in der Helix „füllen“ würden.
In Ruhe bedeckt oder "bedeckt" Tropomyosin die Bindungsstellen von Aktin für Myosin und verhindert so die Wechselwirkung beider Proteine, was zu einer Muskelkontraktion führt. Um jedes dünne Filament und etwa 25 bis 30 m vom Beginn jedes Tropomyosins entfernt befindet sich ein weiteres Protein namens Troponin.
Troponin (Tn) ist ein Proteinkomplex, der aus drei globulären Polypeptiduntereinheiten besteht, die als Troponin T, C und I bezeichnet werden. Jedes Tropomyosinmolekül hat einen assoziierten Troponinkomplex, der es reguliert, und zusammen sind sie für die Regulation der Initiierung und Beendigung der Muskelkontraktion verantwortlich.
Dicke Myofilamente
Die dicken Filamente sind Polymere aus Myosin II mit einem Gewicht von 510 kDa und bestehen aus zwei schweren Ketten mit jeweils 222 kDa und vier leichten Ketten. Es gibt zwei Arten von leichten Ketten: essentielle leichte Ketten mit 18 kDa und regulatorische leichte Ketten mit 22 kDa..
Jede schwere Kette von Myosin II hat die Form eines Stabes mit einem kleinen Kugelkopf am Ende, der fast 90 ° vorsteht und zwei Bindungsstellen aufweist, eine für Actin und eine für ATP. Deshalb gehören diese Proteine zur ATPase-Familie..
Ein dickes Filament besteht aus mehr als 200 Myosin II-Molekülen. Der Kugelkopf jedes dieser Moleküle wirkt während der Kontraktion als „Paddel“ und drückt das Aktin, an dem es befestigt ist, so, dass es in Richtung der Mitte des Sarkomers gleitet..
Organisation
In einer gestreiften Skelettmuskelfaser nehmen die Myofibrillen den größten Teil des Sarkoplasmas ein und sind in Längsrichtung und geordneten Anordnungen in der gesamten Zelle angeordnet.
In einem mit einem optischen Mikroskop gesehenen Längsschnitt werden helle Banden, die als Banden I bezeichnet werden, und dunkle Bänder, die als Banden A bezeichnet werden, beobachtet. Diese Banden entsprechen der geordneten Anordnung der Myofibrillen und daher der Myofilamente, aus denen sie bestehen..
In der Mitte von Band I befindet sich eine dunkle und dünne Linie, die als Linie oder Z-Scheibe bezeichnet wird. Die Mitte jedes Bandes A hat einen helleren Bereich, der als Band H bekannt ist und zentral durch eine dunklere Linie namens Linie M unterteilt ist.
Eingeschränkt zwischen zwei Z-Linien wird eine Struktur namens Sarkomer beschrieben, die die funktionelle Einheit des Skelettmuskels darstellt. Ein Sarkomer besteht aus kontraktilen Myofilamenten, die in geordneter Weise in den Bändern A, H und einem Hemiband I an jedem Ende angeordnet sind..
Die I-Bänder enthalten nur dünne Filamente, das A-Band enthält dicke Filamente, die an ihren beiden Enden mit feinen Filamenten verflochten sind, und das H-Band enthält nur dicke Filamente.
Wie sind Myofilamente in Sarkomeren organisiert??
Bei der Untersuchung einer Skelett-Skelettmuskelprobe unter einem Elektronenmikroskop können sowohl dicke als auch dünne Myofilamente gesehen werden. Diese sollen in einer sequentiellen, geordneten und parallelen Anordnung "ineinander greifen" oder "miteinander verflechten"..
Die dünnen Filamente stammen von den Z-Scheiben und erstrecken sich auf beiden Seiten in die entgegengesetzte Richtung und zur Mitte jedes benachbarten Sarkomers. Von den Z-Scheiben an jedem Ende des Sarkomers wandert Aktin in entspanntem Muskel auf jeder Seite zum Beginn der H-Bande.
Somit nehmen in den Muskelfasern des entspannten Skelettmuskels die dicken Myofilamente den zentralen Bereich ein, der die dunklen Bänder oder A-Bänder bildet; und die dünnen Filamente erstrecken sich auf beiden Seiten des Sarkomers, ohne das Zentrum des Sarkomers zu erreichen.
In einem Querschnitt in dem Bereich, in dem sich die dicken und dünnen Filamente überlappen, kann ein hexagonales Muster beobachtet werden, das das dicke Filament in der Mitte und sechs dünne Filamente, die es umgeben, umfasst und die sich in jeder der Kanten des Sechsecks befinden.
Diese Organisation der Myofilamente im Sarkomer wird durch die Funktion einer Reihe von Proteinen bewahrt, die mit Myofilamenten assoziiert sind und strukturelle Funktionen haben, unter denen Titin, Alpha-Actin, Nebulin, Myomesin und Protein C hervorgehoben werden können..
Mechanismus der Kontraktion
Wenn Acetylcholin (ein Neurotransmitter) durch Stimulation eines Motoneurons in die neuromuskuläre Platte freigesetzt wird, wird die Muskelfaser angeregt und spannungsgesteuerte Calciumkanäle des sarkoplasmatischen Retikulums geöffnet.
Calcium bindet an Troponin C, und dies führt zu einer Konformationsänderung von Tropomyosin, wodurch die aktiven Stellen von Actin freigelegt werden und somit eine Kontraktion ausgelöst wird. Wenn der Kalziumspiegel sinkt, kehrt Tropomyosin in seine Ausgangsposition zurück und die Kontraktion hört auf..
Wenn die Aktin-Bindungsstellen Myosin ausgesetzt werden, können sowohl Proteine binden als auch das Myosin das Aktin in Richtung der Mitte des Sarkomers drücken und über das Myosin gleiten.
Während der Muskelkontraktion nähern sich die Z-Linien jedes Sarkomers dem Zentrum an, nähern sich der M-Linie, erhöhen die Interdigitalisierung zwischen Actin und Myosin und verringern die Größe der I- und H-Banden. Der Grad der Verkürzung hängt von der Summe der Verkürzung ab von jedem der Sarkomere des kontrahierten Muskels.
Verweise
- Bern, R. & Levy, M. (1990). Physiologie. Mosby; Internationale Ausgabe.
- Fox, S. I. (2006). Humanphysiologie (9. Aufl.). New York, USA: McGraw-Hill Press.
- Gartner, L. & Hiatt, J. (2002). Histologie Atlas Text (2. Aufl.). Mexiko D.F .: McGraw-Hill Interamericana Editores.
- Murray, R., Bender, D., Botham, K., Kennelly, P., Rodwell, V. & Weil, P. (2009). Harpers illustrierte Biochemie (28. Ausgabe). McGraw-Hill Medical.
- Rawn, J. D. (1998). Biochemie. Burlington, Massachusetts: Neil Patterson Publishers.
- Ross, M. & Pawlina, W. (2006). Histologie. Ein Text und ein Atlas mit korrelierter Zell- und Molekularbiologie (5. Aufl.). Lippincott Williams & Wilkins.
- West, J. (1998). Physiologische Grundlagen der medizinischen Praxis (12. Aufl.). México D.F.: Editorial Médica Panamericana.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.