
Eigenschaften, Reaktivität, Gefahren, Verwendungen von Natriumhydrid (NaH)

Das Natriumhydrid Es ist eine anorganische Verbindung der Formel NaH. Es hat eine Ionenbindung zwischen Natrium und Hydrid. Seine Struktur ist in Abbildung 1 dargestellt. Es ist repräsentativ für Salzhydride, was bedeutet, dass es ein salzähnliches Hydrid ist, das aus Na + - und H- -Ionen besteht, im Gegensatz zu molekulareren Hydriden wie Boran, Methan, Ammoniak und Wasser.
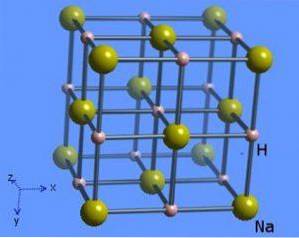
Die Kristallstruktur hat eine Koordinationsnummer 6, wobei jedes Natriummolekül von 8 Hydridionen umgeben ist, die eine oktaedrische Form aufweisen, und ist in Abbildung 2 dargestellt (Mark Winter [Universität Sheffield und WebElements Ltd, 1993-2016)..
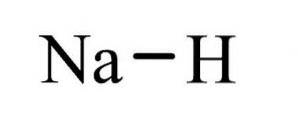
Die Verbindung wird durch die direkte Reaktion zwischen Natrium- und Wasserstoffgas (Natriumhydridformel - Natriumhydridverwendungen, Eigenschaften, Struktur und Formel, 2005-2017) wie folgt hergestellt:
H2 + 2Na → 2NaH
Natriumhydrid wird im Handel als Dispersionsform mit 60 Gew .-% (Gewicht zu Gewichtsprozent) in Mineralöl zur sicheren Handhabung verkauft (Natriumhydroxid, n. D.)..
Artikelverzeichnis
- 1 Physikalische und chemische Eigenschaften von Natriumhydrid
- 2 Reaktivität und Gefahren
- 3 Verwendungen
- 4 Referenzen
Physikalische und chemische Eigenschaften von Natriumhydrid
Natriumhydrid ist ein weißer Feststoff, wenn es rein ist, obwohl es im Allgemeinen grau oder silberfarben ist. Sein Aussehen ist in Abbildung 3 dargestellt.

NaH hat ein Molekulargewicht von 23,99771 g / mol, eine Dichte von 1,396 g / ml und einen Schmelzpunkt von 800 ° C (Royal Society of Chemistry, 2015). Es ist unlöslich in Ammoniak, Benzol, Tetrachlorkohlenstoff und Schwefelkohlenstoff (National Center for Biotechnology Information, n.d.).
Die Verbindung ist extrem instabil. Reines NaH kann sich an der Luft leicht entzünden. Wenn es mit in der Luft vorhandenem Wasser in Kontakt kommt, setzt es leicht entzündlichen Wasserstoff frei.
Wenn NaH offen für Luft und Feuchtigkeit ist, hydrolysiert es auch leicht zu der stark korrosiven Base von Natriumhydroxid (NaOH), basierend auf der Reaktion:
NaH + H 2 O → NaOH + H 2
Bei dieser Reaktion ist zu erkennen, dass sich Natriumhydrid wie eine Base verhält. Dies liegt an der Elektronegativität.
Natrium hat eine signifikant geringere Elektronegativität (~ 1,0) als Wasserstoff (~ 2,1), was bedeutet, dass Wasserstoff die Elektronendichte zu sich zieht und sich von Natrium wegbewegt, um ein Natriumkation und ein Anionenhydrid zu erzeugen.
Damit eine Verbindung eine Brønsted-Säure ist, muss sie die Elektronendichte von Wasserstoff trennen, dh an ein elektronegatives Atom wie Sauerstoff, Fluor, Stickstoff usw. anschließen. Nur dann kann es formal als H + beschrieben und als solches dissoziiert werden.
Ein Hydrid wird viel besser als H- beschrieben und hat ein freies Elektronenpaar. Als solches ist es eine Brønsted-Base, keine Säure. Wenn Sie die Brønsted-Säure / Base-Definition wie Lewis erweitern, werden Sie zu dem Schluss kommen, dass Natrium (Na +) hier die saure Spezies ist..
Das Brønsted-Säure / Base-Reaktionsprodukt von Base H- und Säure H + wird zu H2. Da saurer Wasserstoff direkt aus Wasser extrahiert wird, kann Wasserstoffgas sprudeln und das Gleichgewicht verschieben, selbst wenn die Reaktion thermodynamisch nicht begünstigt wird..
Es können OH-Ionen verbleiben, die mit dem Rest des Na + -Kations zu Natriumhydroxid geschrieben werden können (Warum ist festes Natriumhydrid eine Base und keine Säure, wenn es mit Wasser umgesetzt wird ?, 2016)..
Reaktivität und Gefahren
Die Verbindung ist ein starkes Reduktionsmittel. Greift SiO2 in Glas an. Entzündet sich bei Kontakt mit gasförmigem F2, Cl2, Br2 und I2 (letzteres bei Temperaturen über 100 ° C), insbesondere in Gegenwart von Feuchtigkeit, unter Bildung von HF, HCl, HBr und HI.
Reagiert mit Schwefel zu Na2S und H2S. Kann mit Dimethylsulfoxid explosionsartig reagieren. Reagiert auch bei -60 ° C heftig mit Acetylen. Es ist in Fluor spontan entflammbar.
Initiiert eine Polymerisationsreaktion in Ethyl-2,2,3-trifluorpropionat, so dass sich der Ester heftig zersetzt. Das Vorhandensein von Diethylsuccinat und Ethyltrifluoracetat in der Reaktion hat Explosionen verursacht (SODIUM HYDRIDE, 2016)..
Natriumhydrid wird als ätzend für Haut oder Augen angesehen, da bei Reaktionen mit Wasser möglicherweise ätzende Nebenprodukte auftreten können..
Bei Kontakt mit den Augen sollten diese mindestens 15 Minuten lang mit großen Mengen Wasser unter den Augenlidern gespült werden und sofort einen Arzt aufsuchen..
Bei Hautkontakt sofort bürsten und den betroffenen Bereich mit Wasser abspülen. Bei anhaltender Reizung einen Arzt aufsuchen..
Schädlich beim Verschlucken durch Reaktion auf Wasser. Kein Erbrechen herbeiführen. Suchen Sie sofort einen Arzt auf und bringen Sie das Opfer in eine medizinische Einrichtung..
Natriumhydridöldispersion ist kein Pulver. Das reagierende Material kann jedoch einen feinen ätzenden Nebel abgeben. Bei Einatmen den Mund mit Wasser ausspülen und das Opfer an die frische Luft bringen. Suchen Sie einen Arzt auf (Rhom and Hass Inc., 2007).
Anwendungen
Die Hauptanwendung von Natriumhydrid ist die Durchführung von Kondensations- und Alkylierungsreaktionen, die sich durch die Bildung eines Carbanions (katalysiert durch die Base) entwickeln..
Natriumhydrid in Öl ähnelt Natrium und Natriummetallalkoholaten in seiner Fähigkeit, als Deprotonierungsmittel in Acetessigsäureester-, Claisen-, Stobbe-, Dieckmann-Kondensationen und anderen verwandten Reaktionen zu wirken. Es hat gegenüber anderen Kondensationsmitteln deutliche Vorteile:
- Es ist eine stärkere Base, was zu einer direkteren Deprotonierung führt.
- Es wird kein Überschuss benötigt.
- Das erzeugte H2 gibt ein Maß für das Ausmaß der Reaktion.
- Nebenreaktionen wie Reduktionen werden eliminiert.
Alkylierungen von aromatischen und heterocyclischen Aminen wie 2-Aminopyridin und Phenothiazin werden unter Verwendung von Toluol-Methylformamid-Gemischen leicht in hoher Ausbeute erreicht. Die Dimethylformamidkonzentration ist eine Variable zur Steuerung der Reaktionsgeschwindigkeit (HINCKLEY, 1957)..
Die Verwendung von Natriumhydrid zur Speicherung von Wasserstoff zur Verwendung in Brennstoffzellenfahrzeugen wurde vorgeschlagen, wobei das Hydrid in Kunststoffgranulat eingeschlossen ist, das in Gegenwart von Wasser zerkleinert wird, um den Wasserstoff freizusetzen..
Verweise
- HINCKLEY, M. D. (1957). Herstellung, Handhabung und Verwendung von Natriumhydrid. Advances in Chemistry, Vol. 19, 106-117.
- Mark Winter [Universität Sheffield und WebElements Ltd, U. (1993-2016). Natrium: Natriumhydrid. Von WebElements abgerufen: webelements.com.
- Nationales Zentrum für Informationen zur Biotechnologie. (s.f.). PubChem Compound Database; CID = 24758. Von PubChem abgerufen: pubchem.ncbi.nlm.nih.gov.
- Rhom und Hass inc. (2007, Dezember). Natriumhydrid 60% Dispersion in Öl. Von dow.com abgerufen.
- Royal Society of Chemistry. (2015). Natriumhydrid. Von ChemSpider abgerufen: chemspider.com.
- Natriumhydroxid. (2016). Von Cameochemicals abgerufen: Cameochemicals.noaa.gov.
- Natriumhydridformel - Natriumhydrid Verwendung, Eigenschaften, Struktur und Formel. (2005-2017). Von Softschools.com abgerufen: softschools.com.
- Natriumhydroxid. (s.f.). Abgerufen von chemicalland21: chemicalland21.com.
- Warum ist festes Natriumhydrid eine Base und keine Säure, wenn es mit Wasser umgesetzt wird? (2016, 20. April). Von stackexchange abgerufen: chemie.stackexchange.com.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.