
Grundlage, Vorbereitung und Verwendung des SIM-Mediums
Das halbe SIM ist ein halbfester und differenzieller Agar, der speziell zur Identifizierung einiger Bakterien entwickelt wurde, hauptsächlich aus der Familie der Enterobacteriaceae. Es besteht aus Triptein, Pepton, Eisensulfat, Ammoniumsulfat, Natriumthiosulfat und Agar..
Dieses Medium ermöglicht die Durchführung von drei wichtigen Tests: die Herstellung von Schwefelwasserstoff (H.zweiS), Indolbildung und Motilität, daher kommt das Akronym SIM von. Aufgrund seiner großen Nützlichkeit darf es in einem bakteriologischen Labor nicht fehlen.

Im Gegensatz zu anderen Medien muss es halbfest sein, damit die Bewegungskapazität einiger Bakterien nachweisbar ist. In diesem Sinne funktioniert dieser Test sehr gut für Enterobacteriaceae, jedoch nicht für nicht fermentierende gramnegative Stäbchen, bei denen andere Methoden bevorzugt werden, z. B. das Aufhängen von Tropfen..
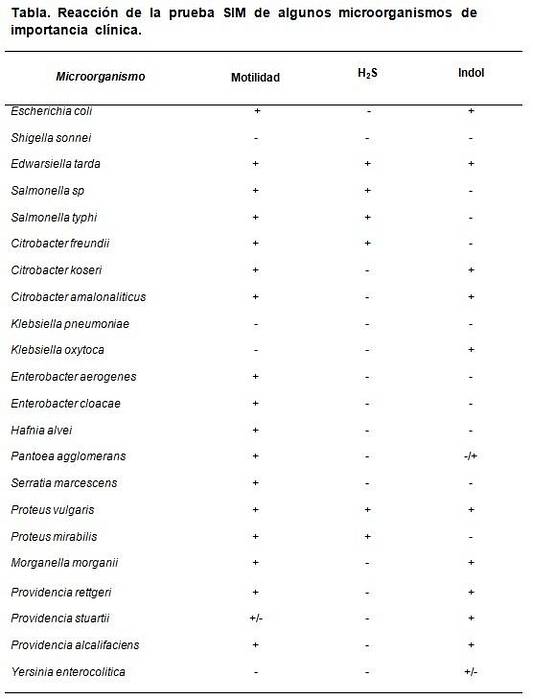
Das SIM-Medium ermöglicht die Unterscheidung bestimmter spezifischer Eigenschaften, die einige Bakterien im Verhältnis zu anderen charakterisieren. Beispielsweise Escherichia coli zeichnet sich durch H auszweiS (-), Indol (+) und Motilität (+), während Proteus mirabilis es SHzweiS (+), Indol (-), Motilität (+).
Artikelverzeichnis
- 1 Begründung
- 1.1 Stromquelle
- 1.2 Herstellung von Schwefelwasserstoff
- 1.3 Bildung von Indol
- 1.4 Motilität
- 2 Vorbereitung
- 2.1 Mittlere SIM
- 2.2 Kovacs Reagenz
- 2.3 Erlichs Reagenz
- 3 Verwendungen
- 3.1 Aussaat
- 4 Qualitätskontrolle
- 5 Einschränkungen
- 6 Referenzen
Basis
Es ist ein Kulturmedium, das als unterschiedlich angesehen wird, da bei seiner Verwendung zwischen Mikroorganismen, die Schwefelwasserstoff produzieren können, und solchen, die dies nicht tun, unterschieden wird. Es hebt auch diejenigen hervor, die Indol aus Tryptophan bilden, von denen, die es nicht bilden, und unterscheidet schließlich die beweglichen Bakterien von den unbeweglichen..
Energiequelle
Wie jedes Kulturmedium enthält es Elemente, die die notwendigen Nährstoffe liefern, damit sich nicht anspruchsvolle Mikroorganismen entwickeln können. Diese Elemente werden durch Peptonen und Triptein dargestellt.
Die Entwicklung des Mikroorganismus im Medium ist wesentlich, um das Vorhandensein oder Fehlen der Eigenschaften, die dieses Medium bewertet, beobachten zu können..
Herstellung von Schwefelwasserstoff
Der Buchstabe S des Akronyms SIM bezieht sich auf die Herstellung von Schwefelwasserstoff (H.zweiS). Bakterien, die Schwefelwasserstoff bilden können, nehmen den Schwefel aus Natriumthiosulfat auf.
Sobald der H.zweiS - farbloses Gas - reagiert mit dem im Medium vorhandenen Eisensalz unter Bildung von Eisen (II) -sulfid, das deutlich sichtbar ist (schwarzer Niederschlag). Bakterien, die kein H bildenzweiJa, lassen Sie die Mitte der Originalfarbe (beige).
Das Vorhandensein des schwarzen Niederschlags kann die Interpretation der Motilität behindern. Es ist jedoch bekannt, dass die meisten H-produzierenden EnterobacteriaceaezweiS sind positive Motilität wie Salmonellen, Proteus und Citrobacter. Darüber hinaus deutet der schwarze Niederschlag, der fast das gesamte Medium bedeckt, auf eine positive Motilität hin.
Indolbildung
Der zweite Buchstabe des Akronyms SIM ist "I", was die Bildung von Indol darstellt.
In diesem Sinne erfüllt Triptein nicht nur eine Nährstoffquelle, sondern erfüllt auch eine andere grundlegende Funktion. Dieses Pepton ist reich an einer Aminosäure namens Tryptophan, daher kann es die Bakterien zeigen, die Tryptophanase produzieren.
Dieses Enzym ist für die Spaltung der Aminosäure Tryptophan verantwortlich, wodurch sich Indol (farblose Substanz), Brenztraubensäure und Ammonium bilden.
Um diese Reaktion zu demonstrieren, muss daher eine aufschlussreiche Substanz (Ehrlich-Reagenz oder Kovac-Reagenz) zugesetzt werden. Beide reagieren mit Indol und bilden auf der Oberfläche des Agars eine rot-fuchsia-ringförmige Substanz. Wenn der Fuchsia-Ring erscheint, wird der Indol-Test als positiv interpretiert.
Bakterien, die dieses Enzym nicht besitzen, bilden keinen Ring und es wird als negativer Indol-Test interpretiert.
Es ist wichtig zu beachten, dass der Indol-Test der letzte sein sollte, der interpretiert wird, da das Medium nach Zugabe des Reagenz trübe wird, was es schwierig macht, die Motilität sichtbar zu machen..
Motilität
Schließlich bedeutet der Buchstabe "M" des Wortes SIM Motilität. Um die Motilität beurteilen zu können, ist dieses Medium strategisch halbfest, da diese Eigenschaft wesentlich ist, um beobachten zu können, ob eine bakterielle Bewegung vorliegt oder nicht. Bakterien mit Flagellen sind diejenigen, die diesen positiven Test geben.
Ein positiver Test ist offensichtlich, wenn eine Trübung sowohl im anfänglichen Inokulum als auch um dieses herum beobachtet wird. Nichtmotile Bakterien entwickeln sich dagegen nur auf dem Weg des ursprünglichen Inokulums.
Vorbereitung
Mittlere SIM
30 g des dehydrierten Mediums werden gewogen und in einem Liter destilliertem Wasser gelöst. Die Mischung wird 5 Minuten stehen gelassen und dann unter häufigem Rühren zum Sieden erhitzt, bis sie sich vollständig aufgelöst hat..
Die Mischung in Reagenzgläsern mit Baumwollkappen verteilen und 15 Minuten bei 121 ° C autoklavieren. Entfernen Sie den Rohrständer aus dem Autoklaven und lassen Sie ihn in vertikaler Position erstarren, so dass das Medium die Form eines Blocks hat.
Zu seiner Konservierung wird es bis zu seiner Verwendung im Kühlschrank aufbewahrt. Das vorbereitete Medium muss einen End-pH von 7,3 ± 0,2 haben.
Zum Zeitpunkt des Inokulierens des Mediums muss es Raumtemperatur haben. Die mittlere Farbe ist beige.
Kovacs Reagenz
Messen Sie 150 ml Amyl- oder Isoamyl- oder Butylalkohol. (Verwenden Sie eine der drei genannten).
10 g p-Dimethylaminobenzaldehyd werden gelöst. Dann langsam 50 ml konzentrierte Salzsäure zugeben.
Das gebrauchsfertige Reagenz ist farblos oder hellgelb. Es sollte in einer Bernsteinflasche aufbewahrt und im Kühlschrank aufbewahrt werden. Nicht verwenden, wenn es eine dunkelbraune Farbe annimmt; das zeigt an, dass es beschädigt ist. Dieses Reagenz wird bevorzugt, wenn es um Enterobacteriaceae geht.
Erlichs Reagenz
2 g p-Dimethylaminobenzaldehyd werden abgewogen und in 190 ml absolutem Ethylalkohol gelöst und langsam mit 40 ml konzentrierter Salzsäure gemischt. Bewahren Sie das Reagenz des Kovac auf die gleiche Weise auf. Ehrlichs Reagenz wird eher für nicht fermentierende und anaerobe Bakterien verwendet.
Anwendungen
SIM-Medium wird in bakteriologischen Labors häufig verwendet. Es hat den Vorteil, dass drei wesentliche Merkmale bei der Identifizierung von Enterobacteriaceae im selben Röhrchen beobachtet werden können..
Gesät
Die richtige Art, dieses Medium zu säen, ist die Verwendung der Nadel, mit der ein Teil der zu untersuchenden reinen Kolonie entnommen und vertikal in die Mitte des Mediums eingeführt wird. Ein einzelner Ausfallschritt sollte durchgeführt werden. Die Punktion sollte nicht den Boden des Rohrs erreichen. Das Richtige ist, nur zwei Drittel der Tiefe abzudecken.
Es wird nicht empfohlen, das Inokulum zu wiederholen, da dies zu falschen Interpretationen der positiven Motilität führen kann. Das beimpfte Medium wird 24 Stunden bei 37 ° C aerob inkubiert..
Nach der Zeit wird beobachtet, ob H produziert wurde oder nichtzweiS und Motilität wird gelesen. Schließlich wird das Indol freigelegt, indem 3 bis 4 Tropfen des Ehrlich- oder Kovac-Reagens zugegeben, vorsichtig gemischt und interpretiert werden.
QA
Zur Sterilitätskontrolle werden ein oder zwei Röhrchen ohne Inokulation in einem Ofen bei 37 ° C 24 Stunden lang inkubiert. Es wird erwartet, dass nach dieser Zeit kein Wachstum oder keine Farbveränderung mehr auftritt.
Zur Qualitätskontrolle können zertifizierte bekannte Stämme verwendet werden, wie z. Escherichia coli ATCC 25922, Enterobacter aerogenes ATCC 13048, Klebsiella pneumoniae ATCC 13883, Salmonella typhimurium ATCC 14028, Shigella sonnei ATCC 29930, Proteus vulgaris ATCC 13315.
Die erwarteten Ergebnisse sind: Escherichia coli H.zweiS negative, Indol- und positive Motilität, Enterobacter aerogenes nur positive Motilität, Salmonella typhimurium H.zweiS und positive Motilität mit negativem Indol. Proteus vulgaris alles positiv, während Klebsiella pneumoniae Y. Shigella sonnei alles negativ.
Einschränkungen
-Einige Stämme von Morganella morganii, Unter anderen Stämmen können sie in diesem Medium aufgrund der Produktion von Melanin ein bräunliches Pigment erzeugen, dies sollte nicht mit dem Niederschlag von Eisensulfid verwechselt werden. Bei unerfahrenen Fachleuten kann diese Situation bei der Interpretation des H-Tests zu falsch positiven Ergebnissen führen.zweiS..
-Strenge aerobe Bakterien wachsen nur auf der Oberfläche des Röhrchens, was es schwierig macht, die Motilität zu interpretieren.
Verweise
- BD Laboratories. BBL SIM Medium. 2008. Verfügbar unter: bd.com
- Neogen Laboratories. SIM Medium. Erhältlich bei: Foodsafety
- Difco Francisco Soria Melguizo. SIM Medium. 2009. Verfügbar unter: http://f-soria.es
- Brizuela-Lab Labor. Mittlere SIM. Verfügbar unter: .brizuela-lab.com
- Britannia Laboratories. Mittlere SIM. 2015. Verfügbar unter: studyres.es/doc
- Koneman E., Allen S., Janda W., Schreckenberger P., Winn W. (2004). Mikrobiologische Diagnose. 5. Aufl. Editorial Panamericana S.A. Argentinien.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.