
Mittlere MIO-Grundlage, Vorbereitung und Verwendung
Das halbes MIO ist ein biochemischer Test, der zur Identifizierung von Bakterienarten der Familie der Enterobacteriaceae verwendet wird. Es ist sehr nahrhaft und besteht aus Glucose, Hefeextrakt, Pepton, Triptein, L-Ornithinhydrochlorid, Bromkresolpurpur und Agar.
Die Bedeutung seines Akronyms (MIO) beschreibt jeden der Parameter, die in diesem Medium beobachtet werden können; Motilität, Indol und Ornithin. Motilität ist die Fähigkeit des Mikroorganismus, sich aufgrund des Vorhandenseins von Flagellen zu bewegen. Damit diese Eigenschaft beobachtet werden kann, muss die Konsistenz des Mediums halbfest sein, damit die Zubereitung weniger Agar enthält..
Die Produktion von Indol zeigt das Vorhandensein des Enzyms Tryptophanase, das auf die Aminosäure Tryptophan wirkt, was die Verwendung eines aufschlussreichen Reagens erfordert, um die Produktion von Indol sichtbar zu machen..
Schließlich bestimmt Ornithin, ob das Bakterium die Aminosäure decarboxylieren kann, dh ob es das Enzym Orinithin-Decarboxylase enthält.
Artikelverzeichnis
- 1 Begründung
- 1.1 Pepton, Hefeextrakt und Triptein
- 1.2 Motilität
- 1.3 Glukose
- 1,4 L-Ornithin
- 1,5 pH-Indikator
- 2 Aussaat- und Entwicklungstechnik
- 3 Vorbereitung
- 3.1 MIO-Medium
- 3.2 Kovacs-Reagenz (Indol-Testentwickler)
- 4 Verwenden
- 5 Qualitätskontrolle
- 6 Referenzen
Basis
Pepton, Hefeextrakt und Triptein
Diese Elemente tragen zur Nährstoffkraft dieses Mediums bei. Sie dienen als Nährstoffquelle und essentielle Aminosäuren für die Bakterienentwicklung.
Darüber hinaus ist Triptein eine Tryptophanquelle, um das Vorhandensein des Enzyms Tryptophanase nachzuweisen, das Tryptophan durch reduktive Desaminierung abbaut und Indol, Brenztraubensäure, Ammoniak und Energie freisetzt..
Indol ist farblos, daher wird seine Anwesenheit durch Zugabe von fünf Tropfen Ehrlichs oder Kovacs-Reagens, beide mit p-Dimethylaminobenzaldehyd, nachgewiesen..
Die Aldehydgruppe dieser Verbindung reagiert mit Indol und erzeugt ein ringförmiges, fuchsia-rotes Produkt auf der Oberfläche des Agars..
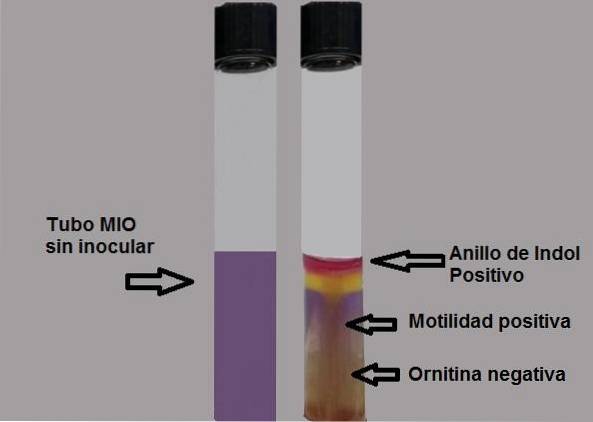
Jede Farbspur sollte als positiver Test betrachtet werden. Der Proof sollte sofort gelesen werden, da sich die Farbe mit der Zeit verschlechtert.
Darüber hinaus sollte dieser Test aufgedeckt werden, nachdem die Motilitäts- und Decarboxylierungsergebnisse von Ornithin festgestellt wurden..
Interpretation
Positiver Test: Bildung eines fuchsia-roten Rings bei Zugabe von Tropfen des Kovacs-Reagens.
Negativer Test: keine Ringbildung.
Motilität
Die Fähigkeit der Bakterien, sich zu bewegen, wird nachgewiesen, wenn ein trübes Medium beobachtet wird oder wenn sich eine dicke Wachstumslinie um die anfängliche Inokulation ausdehnt..
Ein negativer Motilitätstest wird durch Beobachtung einer dünnen Wachstumslinie nachgewiesen, und alles um ihn herum wird ohne Wachstum sein..
Es ist wichtig, dass die Motilität abgelesen wird, bevor das Indol sichtbar wird, da die Zugabe des Reagens das gesamte Medium trübt..
Bei mobilen, aber langsam wachsenden Bakterien ist es schwierig, ihre Beweglichkeit mit diesem Medium nachzuweisen. In diesem Fall wird empfohlen, andere Tests oder Methoden zu verwenden, z. B. die mittlere Motilität oder die Drop-Pending-Methode..
Glucose
Glucose ist das fermentierbare Kohlenhydrat, das neben der Bereitstellung von Energie auch die Umwelt ansäuert, eine notwendige Voraussetzung für die Decarboxylierung der Aminosäure Ornithin..
Die Glukosefermentation muss immer erfolgen, ausgehend von dem Prinzip, dass alle Bakterien der Enterobacteriaceae-Familie Glukose fermentieren..
L-Ornithin
Falls die Bakterien das Enzym Ornithin-Decarboxylase produzieren, kann dies wirken, sobald das Medium durch Fermentation von Glucose angesäuert wurde..
Das Enzym Ornithin-Decarboxylase wirkt auf die Carboxylgruppe der Aminosäure und produziert ein Amin namens Putresin, das das Medium wieder alkalisiert.
Dieser Test sollte nach 24 Stunden Inkubation gelesen werden, denn wenn Sie versuchen zu lesen, bevor Sie den Test mit einem falsch negativen Ergebnis falsch interpretieren können.
Es muss daran erinnert werden, dass die erste Reaktion die Fermentation von Glucose ist, weshalb das Medium in einer Anfangsphase (die ersten 10 bis 12 Stunden) gelb wird. Wenn anschließend eine Ornithin-Decarboxylierung auftritt, wird das Medium lila.
Es ist wichtig, den Ornithin-Decarboxylierungstest zu interpretieren, bevor Indol sichtbar wird, da die Zugabe von Kovacs 'Reagenz die Farbe des Mediums verändert..
Interpretation
Negativer Test: gelber mittlerer oder gelber Hintergrund.
Positiver Test: halb ganz lila.
PH-Anzeige
In diesem Fall wird Bromkresolpurpur verwendet; derjenige, der für das Aufdecken zuständig ist, wenn sich der pH-Wert im Medium ändert. Wenn der Indikator angesäuert ist, wird er gelb und wenn er alkalisiert ist, wird er lila.
Aussaat- und Entwicklungstechnik
Zur Aussaat des MIO-Mediums wird eine gerade Schlaufe oder Nadel verwendet und damit ein Teil der zu untersuchenden Kolonie gesammelt..
Eine tiefe Punktion wird in der Mitte des MIO in einer geraden Linie durchgeführt. Es ist nicht ratsam, eine Doppelpunktion durchzuführen, da dies ein falsches Bild der Motilität vermitteln kann, wenn die Punktionen nicht an derselben Stelle durchgeführt werden.
24 bis 48 Stunden bei 37 ° C in Aerobiose inkubieren. Beobachten Sie die Ergebnisse in dieser Reihenfolge: Motilität, Decarboxylierung des Ornithins und schließlich das Indol.
Es ist ratsam, 2 ml des Mediums aseptisch zu entfernen, es in ein steriles Röhrchen zu überführen und dort den Indol-Test durchzuführen, damit der Rest des ursprünglichen Röhrchens, falls es negativ ist, weitere 24 Stunden inkubiert werden kann, um das zu enthüllen wieder Indol..
Die Entwicklung des Indols wird wie folgt durchgeführt: 3 bis 5 Tropfen Kovacs-Reagenz werden zu dem MIO-Medium gegeben und es wird heftig geschüttelt. Es wird beobachtet, ob ein roter Fuchsienring erscheint oder nicht.
Vorbereitung
Mittleres MIO
31 g des MIO-Mediums werden abgewogen und in einem Liter destilliertem Wasser gelöst..
Erhitzen, bis die Mischung eine Minute lang kocht, dabei häufig schütteln, bis sich der Agar vollständig aufgelöst hat. Verteilen Sie 4 ml des Mediums in 13/100 Reagenzgläsern mit Baumwollkappen.
Im Autoklaven 15 Minuten bei 121 ° C sterilisieren. Aus dem Autoklaven nehmen und gerade in einem Gestell stehen lassen, so dass ein halbfester Block entsteht.
Im Kühlschrank bei 2-8 ° C lagern. Vor der Aussaat des Bakterienstamms erwärmen lassen.
Die Farbe des dehydrierten Mediums ist beige und die des vorbereiteten Mediums leicht opaleszierendes Purpur..
Der End-pH des hergestellten Mediums beträgt 6,5 ± 0,2
Das Medium wird bei saurem pH gelb und bei alkalischem pH lila.
Kovacs-Reagenz (Indol-Testentwickler)
Dieses Reagenz wird wie folgt hergestellt:
Es werden 150 ml Amyl-, Isoamyl- oder Butylalkohol (einer der drei) gemessen. Darin sind 10 g p-Dimethylaminobenzaldehyd gelöst. Anschließend werden langsam 50 ml konzentrierte Salzsäure zugegeben..
Das hergestellte Reagenz ist farblos oder hellgelb. Es sollte in einer Bernsteinflasche und im Kühlschrank aufbewahrt werden. Eine dunkelbraune Farbe zeigt ihre Verschlechterung.
Auch das Kovacs-Reagenz kann das Ehrlich-Reagenz ersetzen. Letzteres ist empfindlicher und bevorzugt Indol in Bakterien, die es in winzigen Mengen produzieren, wie in einigen nicht fermentierenden gramnegativen Stäbchen und bestimmten Anaerobier..
Benutzen
Dieses Medium ist ein Test, der eine Reihe biochemischer Tests zur Identifizierung von Bakterien aus der Familie der Enterobacteriaceae ergänzt..
Die Daten der Decarboxylierung von Ornithin dienen zur Unterscheidung zwischen Shigella sonnei, das gibt positiv, von Shigella boydii, Shigella flexneri und S. dysenterieae, das gibt Negative.
Es unterscheidet auch die Gattung Klebsiella, die negativ getestet wird, von der Gattung Enterobacter, bei der die meisten ihrer Arten positiv getestet werden..
QA
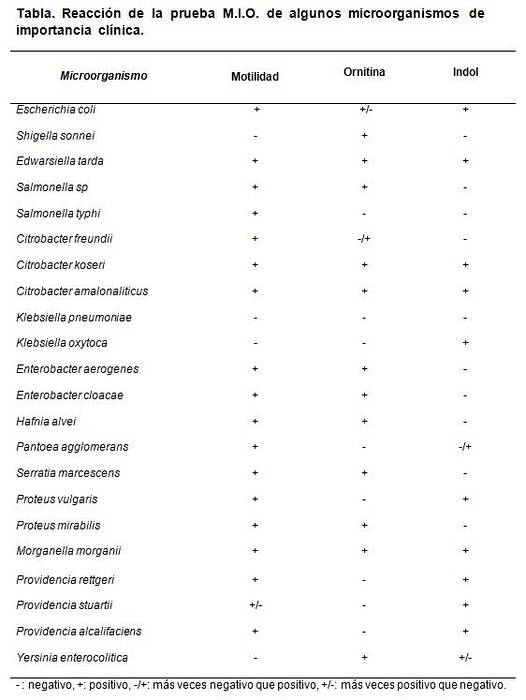
Jedes Mal, wenn eine Charge MIO-Medium hergestellt wird, kann ein Kontrolltest durchgeführt werden. Hierzu werden bekannte oder zertifizierte Stämme verwendet, um das Verhalten des Mediums zu beobachten..
Die Stämme, die verwendet werden können, sind Escherichia coli, Morganella morganii, Klebsiella pneumoniae, Enterobacter aerogenes Y. Proteus mirabilis.
Die erwarteten Ergebnisse sind E. coli und M. morganii. Dan M: +, I: + und O: +.
Klebsiella pneumoniae gibt alles negativ (M: -, I: -, O :-). Proteus mirabilis Y. Enterobacter aerogenes gib M: + I: - und O: +.
Verweise
- Mac Faddin J. (2003). Biochemische Tests zur Identifizierung von Bakterien von klinischer Bedeutung. 3rd ed. Editorial Panamericana. Buenos Aires. Argentinien.
- Forbes B., Sahm D., Weissfeld A. (2009). Bailey & Scott Mikrobiologische Diagnose. 12 ed. Editorial Panamericana S.A. Argentinien.
- Koneman E., Allen S., Janda W., Schreckenberger P., Winn W. (2004). Mikrobiologische Diagnose. 5. Aufl. Editorial Panamericana S.A. Argentinien.
- Britannia Laboratories. MIO Medio 2015. Verfügbar unter: britanialab.com
- BD Laboratories. BBL Motility Indol Ornithine (MIO) Medium. 2007. Verfügbar unter: bd.com
- Valtek Laboratories. Medium M.I.O. Motilität, Indol, Ornithin. 2010. Verfügbar unter: andinamedica.com



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.