
Lysozym Eigenschaften, Struktur, Funktionen
Das Lysozyme Es handelt sich um hydrolytische Enzyme, die in der Natur weit verbreitet sind und die glykosidischen Bindungen des Peptidoglykans in der Wand von Bakterien hydrolysieren können. Sie kommen in Pflanzen und Tieren vor und wirken als Abwehrmechanismus gegen bakterielle Infektionen.
Die Entdeckung dieser Enzyme geht auf das Jahr 1922 zurück, als Alexander Fleming erkannte, dass es ein Protein gab, das die katalytische Fähigkeit hatte, Bakterien in einigen menschlichen Geweben und Sekreten zu lysieren..
Aufgrund seiner einfachen Gewinnung und seiner geringen Größe war Lysozym eines der ersten Enzyme, die sequenziert wurden und deren Struktur durch Röntgenstrahlen bestimmt wurde. Derzeit wird es als Modellsystem in der Chemie, Enzymologie, Kristallographie und Molekularbiologie von Proteinen verwendet..
Lysozym ist ein "bakteriolytisches" Enzym, das sich auf die Hydrolyse der β-1,4-glycosidischen Bindungen spezialisiert hat, die sich zwischen N-Acetylmuraminsäure und N-Acetylglucosamin bilden, das in der Peptidoglycan-Zellwand vorhanden ist und insbesondere in den grampositiven Bakterien exponiert ist.
Es hat verschiedene Funktionen, sowohl verdauungsfördernd als auch immunologisch, in allen Organismen, in denen es exprimiert und als biotechnologische Ressource für verschiedene Zwecke verwendet wird..
Artikelverzeichnis
- 1 Funktionen
- 2 Arten von Lysozymen bei Tieren und ihre Eigenschaften
- 2.1 Lysozyme Typ C.
- 2.2 Lysozyme Typ G.
- 2.3 Lysozyme Typ I.
- 3 Struktur
- 4 Funktionen
- 5 Referenzen
Eigenschaften
Lysozyme werden von den Hauptgruppen lebender Organismen auf dem Planeten exprimiert, sind jedoch bei Tieren besonders häufig und wurden von diesen weiter gereinigt und untersucht..
Beim Menschen kommt Lysozym in hohen Konzentrationen in verschiedenen Flüssigkeiten und Geweben wie Leber, Knorpel, Speichel, Schleim und Tränen vor. Es wird von hämatopoetischen Zellen exprimiert und kommt auch in Granulozyten, Monozyten und Makrophagen sowie in anderen Vorläuferzellen des Knochenmarks vor..
Lysozyme pflanzlichen Ursprungs hydrolysieren Substrate, die denen ähneln, die von anderen eng verwandten Enzymen verwendet werden, die als Chitinasen bekannt sind. Aus diesem Grund können sie auch Bindungen in Chitin hydrolysieren, wenn auch mit geringerer Effizienz.
Arten von Lysozymen bei Tieren und ihre Eigenschaften
Im Tierreich wurden mindestens drei Arten von Lysozymen beschrieben:
-Typ C Lysozyme ("C" von "ckonventionelles "oder"chicken ", Was bedeutet Huhn auf Englisch?
-Typ G Lysozyme ("G" von "Goose”, Was auf Englisch Gans bedeutet) und
-Typ I Lysozyme ("I" von "ichWirbeltiere ”)
Die drei Klassen von Lysozymen unterscheiden sich hinsichtlich ihrer Aminosäuresequenzen, ihrer biochemischen Eigenschaften und ihrer enzymatischen Eigenschaften..
Typ C Lysozyme
Diese Lysozyme gelten als "Modell" -Enzyme dieser Familie, da sie als Modell für Untersuchungen von Struktur und Funktion gedient haben. Sie sind als Typ "C" des Englischen bekannt.Hähnchen”Da sie zum ersten Mal aus dem Weiß von Hühnereiern isoliert wurden.
In diese Klasse fallen die Lysozyme, die von den meisten Wirbeltieren, insbesondere Vögeln und Säugetieren, produziert werden. Es enthält auch Enzyme, die in einigen Arthropoden wie Lepidoptera, Diptera, einigen Spinnentieren und Krebstieren vorhanden sind.
Sie sind kleine Enzyme, da sie ein Molekulargewicht haben, das 15 kDa nicht überschreitet. Sie sind Grundproteine mit hohen isoelektrischen Punkten.
Lysozyme Typ G.
Das erste Lysozym dieses Typs wurde in Gänseeiweiß identifiziert und kommt in zahlreichen Vogelarten wie Hühnern, Schwänen, Straussen, Kasuaren und anderen vor..
In einigen Fällen sind Typ-G-Lysozyme im Eiweiß bestimmter Vögel häufiger als Typ-C-Lysozyme, während in anderen Fällen das Gegenteil der Fall ist, sind Typ-C-Lysozyme häufiger.
Diese Lysozyme kommen auch in Muscheln und in einigen Manteltieren vor. Sie sind etwas größer als Typ C-Proteine, aber ihr Molekulargewicht überschreitet gewöhnlich 25 kDa nicht.
Typ I Lysozyme
Diese Lysozyme kommen hauptsächlich bei wirbellosen Tieren vor. Sein Vorhandensein wurde bei Anneliden, Stachelhäutern, Krebstieren, Insekten, Weichtieren und Nematoden festgestellt und fehlt bei Säugetieren und anderen Wirbeltieren..
Sie haben mehr saure isoelektrische Punkte als die Proteine vom Typ C und Typ G..
Struktur
Die drei im vorherigen Abschnitt beschriebenen Arten von tierischen Enzymen weisen ziemlich ähnliche dreidimensionale Strukturen auf..
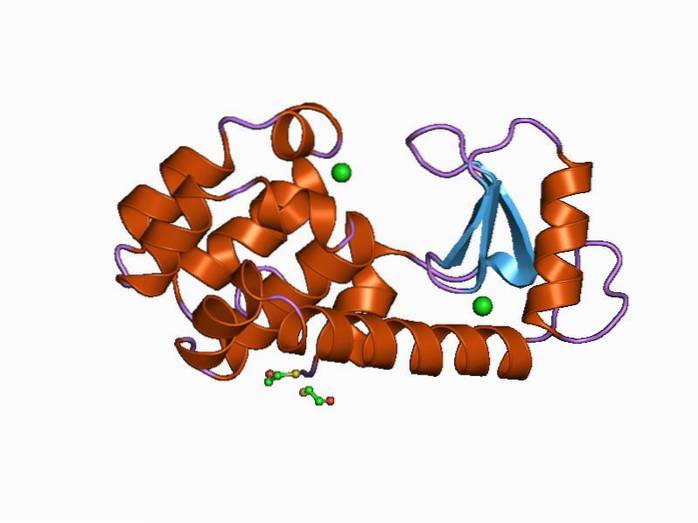
Humanes Lysozym ist ein Typ C-Lysozym und war das erste dieser Enzyme, das untersucht und strukturell charakterisiert wurde. Es ist ein kleines Protein mit 130 Aminosäureresten und wird von einem Gen auf Chromosom 12 kodiert, das 4 Exons und 3 Introns aufweist..
Seine Struktur ist in zwei Bereiche unterteilt: einen als α-Domäne und eine andere wie β-Domäne. Die α-Domäne besteht aus vier Alpha-Helices und die β-Domäne besteht aus einem antiparallelen β-Faltblatt und einer großen Schleife.
Die katalytische Stelle des Enzyms befindet sich in der Spalte, die zwischen beiden Domänen gebildet wird, und zur Bindung an das Substrat weist es Glutaminsäure- und Asparaginsäurereste auf. Zusätzlich hat es mindestens sechs "Unterstellen", die als A, B, C, D, E und F bekannt sind und an sechs aufeinanderfolgende Zuckerreste binden können.
Eigenschaften
Lysozym hat nicht nur physiologische Funktionen beim Schutz und der Bekämpfung von bakteriellen Infektionen in den Organismen, die es exprimieren, sondern war, wie erwähnt, als Modellenzym unter chemischen, enzymatischen und strukturellen Gesichtspunkten sehr nützlich.
In der heutigen Industrie ist es als starkes Bakterizid anerkannt und wird zur Konservierung von Lebensmitteln und Arzneimitteln verwendet.
Dank der Reaktion, die diese Enzyme katalysieren, können sie auf verschiedene Bakterienpopulationen einwirken und die Stabilität ihrer Wände verändern, was sich später in einer Zelllyse niederschlägt..
In Verbindung mit anderen ähnlichen Enzymen können Lysozyme sowohl auf grampositive als auch auf gramnegative Bakterien einwirken, sodass sie als Teile des antibakteriellen „Immunsystems“ verschiedener Klassen von Organismen betrachtet werden können.
In den weißen Blutkörperchen im Blut von Säugetieren haben diese Enzyme wichtige Funktionen beim Abbau eindringender Mikroorganismen, was sie für das Immunsystem von Menschen und anderen Säugetieren essentiell macht.
Lysozyme in Pflanzen erfüllen im Wesentlichen die gleichen Funktionen wie bei den Tieren, die sie exprimieren, da sie die erste Verteidigungslinie gegen bakterielle Krankheitserreger darstellen..
Verweise
- Callewaert, L. & Michels, W. (2010). Lysozyme im Tierreich. J. Biosci., 35(1), 127-160.
- Merlini, G. & Bellotti, V. (2005). Lysozym: Ein paradigmatisches Molekül zur Untersuchung von Proteinstruktur, -funktion und -fehlfaltung. Chimica Acta Klinik, 357, 168-172.
- Mir, A. (1977). Lysozym: eine kurze Überprüfung. Postgraduate Medical Journal, 53, 257-259.
- Sahoo, N. R., Kumar, P., Bhusan, B., Bhattacharya, T. K., Dayal, S. & Sahoo, M. (2012). Lysozym in Nutztieren: Ein Leitfaden zur Auswahl von Krankheiten. Journal of Animal Science Fortschritte, zwei(4), 347 & ndash; 360.
- Wohlkönig, A., Huet, J., Looze, Y. & Wintjens, R. (2010). Strukturelle Beziehungen in der Lysozym-Superfamilie: Signifikante Hinweise auf Glycosidhydrolase-Signaturmotive. Plus eins, 5(11), 1-10.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.