
Isomerase Prozesse, Funktionen, Nomenklatur und Unterklassen
Das Isomerasen Sie sind eine Klasse von Enzymen, die an der strukturellen oder positionellen Umlagerung von Isomeren und Stereoisomeren verschiedener Moleküle beteiligt sind. Sie sind in praktisch allen zellulären Organismen vorhanden, die Funktionen in verschiedenen Kontexten erfüllen.
Enzyme dieser Klasse wirken auf ein einzelnes Substrat, obwohl einige unter anderem kovalent mit Cofaktoren, Ionen, assoziiert sein können. Die allgemeine Reaktion kann daher wie folgt gesehen werden:
X-Y → Y-X
Die durch diese Enzyme katalysierten Reaktionen beinhalten eine interne Umlagerung der Bindungen, was unter anderem Änderungen der Position funktioneller Gruppen, der Position von Doppelbindungen zwischen Kohlenstoffen ohne Änderung der Molekülformel des Substrats bedeuten kann..
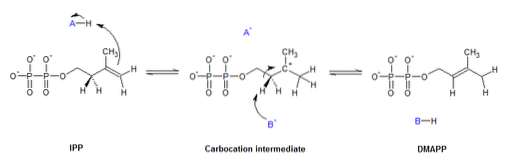
Isomerasen erfüllen verschiedene Funktionen in einer Vielzahl von biologischen Prozessen, einschließlich Stoffwechselwegen, Zellteilung, DNA-Replikation, um nur einige zu nennen..
Isomerasen waren die ersten Enzyme, die industriell zur Herstellung von Sirupen und anderen zuckerhaltigen Lebensmitteln verwendet wurden, da sie die Isomere verschiedener Arten von Kohlenhydraten ineinander umwandeln konnten.
Artikelverzeichnis
- 1 Biologische Prozesse, an denen sie beteiligt sind
- 2 Funktionen
- 3 Nomenklatur
- 4 Unterklassen
- 4.1 EC.5.1 Racemasen und Epimerasen
- 4.2 EC.5.2 Cis-trans-Isomerasen
- 4.3 EC.5.3 Intramolekulare Isomerasen
- 4.4 EC.5.4 Intramolekulare Transferasen (Mutasen)
- 4.5 EC.5.5 Intramolekulare Lyasen
- 4.6 EC.5.6 Isomerasen, die die makromolekulare Konformation verändern
- 4.7 EC.5.99 Andere Isomerasen
- 5 Referenzen
Biologische Prozesse, an denen sie beteiligt sind
Isomerasen sind an mehreren lebenswichtigen zellulären Prozessen beteiligt. Zu den bekanntesten zählen die durch Topoisomerasen katalysierte DNA-Replikation und -Verpackung. Diese Ereignisse sind entscheidend für die Replikation der Nukleinsäure sowie für ihre Kondensation vor der Zellteilung..
Die Glykolyse, einer der zentralen Stoffwechselwege in der Zelle, umfasst mindestens drei isomere Enzyme, nämlich: Phosphoglucoseisomerase, Triosephosphatisomerase und Phosphoglyceratmutase..
Die Umwandlung von UDP-Galactose in UDP-Glucose im Galactose-Katabolismusweg wird durch die Wirkung einer Epimerase erreicht. Beim Menschen ist dieses Enzym als UDP-Glucose-4-Epimerase bekannt..
Die Proteinfaltung ist ein wesentlicher Prozess für die Funktion vieler Enzyme in der Natur. Das Protein-Disulfid-Isomerase-Enzym unterstützt die Faltung von Proteinen, die Disulfidbrücken enthalten, indem es ihre Position in den Molekülen modifiziert, die es als Substrate verwendet..
Eigenschaften
Die Hauptfunktion von Enzymen, die zur Klasse der Isomerasen gehören, kann darin gesehen werden, ein Substrat durch eine kleine Strukturänderung umzuwandeln, um es beispielsweise für die weitere Verarbeitung durch Enzyme stromabwärts in einem Stoffwechselweg anfällig zu machen.
Ein Beispiel für eine Isomerisierung ist der Wechsel von der Phosphatgruppe in Position 3 zum Kohlenstoff in Position 2 des 3-Phosphoglycerats, um es in 2-Phosphoglycerat umzuwandeln, das durch das Enzym Phosphoglyceratmutase im glykolytischen Weg katalysiert wird, wodurch eine Verbindung mit höherer Energie erzeugt wird Was ist ein funktionelles Substrat der Enolase.
Nomenklatur
Die Klassifizierung von Isomerasen folgt den von der Enzymkommission vorgeschlagenen allgemeinen Regeln für die Klassifizierung von Enzymen (Enzymkommission) im Jahr 1961, in dem jedes Enzym einen numerischen Code für seine Klassifizierung erhält.
Die Position der Zahlen in diesem Code gibt jede der Abteilungen oder Kategorien in der Klassifizierung an, und diesen Zahlen sind die Buchstaben "EC" vorangestellt..
Bei Isomerasen steht die erste Zahl für die enzymatische Klasse, die zweite für die Art der Isomerisierung, die sie durchführen, und die dritte für das Substrat, auf das sie einwirken..
Die Nomenklatur der Isomerase-Klasse lautet EC.5. Es hat sieben Unterklassen, so dass Enzyme mit dem Code von EC.5.1 bis EC.5.6 gefunden werden. Es gibt eine sechste "Unterklasse" von Isomerasen, die als "andere Isomerasen" bekannt ist und deren Code EC.5.99 lautet, da sie Enzyme mit verschiedenen Isomerasefunktionen enthält..
Die Bezeichnung der Unterklassen erfolgt hauptsächlich nach der Art der Isomerisierung, die diese Enzyme durchführen. Trotzdem können sie auch Namen wie Racemasen, Epimerasen erhalten, cis-trans-Isomerasen, Isomerasen, Tautomerasen, Mutasen oder Cycloisomerasen.
Unterklassen
Es gibt 7 Klassen von Enzymen innerhalb der Isomerase-Familie:
EC.5.1 Racemasen und Epimerasen
Sie katalysieren die Bildung von racemischen Gemischen basierend auf der Position des α-Kohlenstoffs. Sie können auf Aminosäuren und Derivate (EC.5.1.1), auf Hydroxysäuregruppen und -derivate (EC.5.1.2), auf Kohlenhydrate und Derivate (EC.5.1.3) und andere (EC.5.1.99) einwirken..
EC.5.2 Cis-trans-Isomerasen
Katalysieren Sie die Umwandlung zwischen isomeren Formen cis Y. trans von verschiedenen Molekülen.
EC.5.3 Intramolekulare Isomerasen
Diese Enzyme sind für die Isomerisierung der inneren Teile im selben Molekül verantwortlich. Einige führen Redoxreaktionen durch, bei denen Elektronendonor und -akzeptor dasselbe Molekül sind, sodass sie nicht als Oxidoreduktasen klassifiziert werden.
Sie können wirken, indem sie Aldosen und Ketosen (EC.5.3.1) auf Keto- und Enolgruppen (EC.5.3.2) umwandeln und die Position von CC-Doppelbindungen (EC.5.3.3) von SS-Disulfidbindungen ändern (EC.5.3.4) und andere „Oxidoreduktasen“ (EC.5.3.99).
EC.5.4 Intramolekulare Transferasen (Mutasen)
Diese Enzyme katalysieren die Positionsänderungen verschiedener Gruppen innerhalb desselben Moleküls. Sie werden nach der Art der Gruppe klassifiziert, die sie "bewegen"..
Es gibt die Phosphomutasen (EC.5.4.1), diejenigen, die Aminogruppen übertragen (EC.5.4.2), diejenigen, die Hydroxylgruppen übertragen (EC.5.4.3) und diejenigen, die andere Arten von Gruppen übertragen (EC.5.4) 99).
EC.5.5 Intramolekulare Lyasen
Sie katalysieren die "Eliminierung" einer Gruppe, die Teil eines Moleküls ist, aber dennoch kovalent daran gebunden ist.
EC.5.6 Isomerasen, die die makromolekulare Konformation verändern
Sie können wirken, indem sie die Konformation von Polypeptiden (EC.5.6.1) oder Nukleinsäuren (EC.5.6.2) verändern..
EC.5.99 Andere Isomerasen
Diese Unterklasse vereint Enzyme wie Thiocyanat-Isomerase und 2-Hydroxychrom-2-carboxylat-Isomerase..
Verweise
- Adams, E. (1972). Aminosäuren Racemasen und Epimerasen. Die Enzyme, 6, 479-507.
- Boyce, S. & College, T. (2005). Enzymklassifikation und Nomenklatur. Enzyklopädie der Biowissenschaften, 1-11.
- C. Z. Cai, L. Y. Han, Z. L. Ji & Y. Z. Chen (2004). Klassifizierung der Enzymfamilie nach Support Vector Machines. Proteine: Struktur, Funktion und Bioinformatik, 55, 66-76.
- Dugave, C. & Demange, L. (2003). Cis - Transisomerisierung von organischen Molekülen und Biomolekülen: Implikationen und Anwendungen. Chemische Bewertungen, 103, 2475-2532.
- Enzyklopädie Britannica. (2018). Abgerufen am 3. März 2019 von britannica.com
- R. B. Freedman, T. R. Hirst & M. F. Tuite (1994). Proteindisulfidisomerase: Brücken bauen bei der Proteinfaltung. TIBS, 19, 331-336.
- Murzin, A. (1996). Strukturelle Klassifikation von Proteinen: neue Superfamilien Alexey G Murzin. Strukturelle Klassifikation von Proteinen: Neue Superfamilien, 6, 386-394.
- Nelson, D. L. & Cox, M. M. (2009). Lehninger Prinzipien der Biochemie. Omega-Ausgaben (5. Aufl.).
- Nomenklaturausschuss der Internationalen Union für Biochemie und Molekularbiologie (NC-IUBMB). (2019). Abgerufen von qmul.ac.uk.
- J. B. Thoden, P. A. Frey & H. M. Holden (1996). Molekülstruktur des abortiven NADH / UDP-Glucose-Komplexes der UDP-Galactose-4-Epimerase aus Escherichia coli: Implikationen für den katalytischen Mechanismus. Biochemie, 35, 5137-5144.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.