
Immunglobulin D Struktur, Funktion und Normalwerte

Das Immunglobulin D. (IgD), entdeckt 1965, ist ein Oberflächen-Immunglobulin, das (zusammen mit IgM) vor ihrer Aktivierung in der Membran von B-Lymphozyten (mIgD) gefunden wird.
Es hat seine Funktion als Ausgangsrezeptor für Antigene. IgD ist dank seiner Sekretion (sIgD) auch im Plasma frei. Es hat ein Molekulargewicht von 185.000 Dalton und macht etwa 1% der Immunglobuline in einem Organismus aus.
Artikelverzeichnis
- 1 Was sind Immunglobuline??
- 2 Struktur
- 3 Funktion und Krankheiten
- 3.1 sIgD
- 3,2 mIgD
- 3,3 B-Lymphozyten
- 3.4 Immunentzündliches System
- 4 Normalwerte
- 4.1 Serumkonzentration
- 4.2 Blutwerte
- 5 Referenzen
Was sind Immunglobuline??
Immunglobuline oder Antikörper sind hochspezifische komplexe globuläre Glykoproteine, die von B-Lymphozyten synthetisiert werden, Zellen, die für die Immunantwort im Körper von Tieren verantwortlich sind..
Immunglobuline interagieren mit Molekülen, die der Körper als Nicht-Selbst oder Antigene identifiziert. Jede Substanz, die die Immunantwort im Körper aktivieren kann, wird als Antigen bezeichnet..
Die Familie der Ig-Antikörpermoleküle umfasst diejenigen, die vor ihrer Aktivierung im Blutplasma zirkulieren, und diejenigen, die sich auf der Oberfläche von B-Lymphozyten befinden..
Es gibt fünf Arten von Immunglobulinen: IgG, IgD, IgE, IgA und IgM (identifiziert unter anderem bei Menschen, Mäusen, Hunden, Reptilien, Fischen), die sich strukturell durch ihre konstanten Regionen in der schweren Kette unterscheiden. Diese Unterschiede verleihen ihnen besondere funktionelle Eigenschaften.
Antikörper wirken als spezifische Sensoren für Antigene. Mit diesen bilden sie Komplexe, die eine für das Immunsystem typische Reaktionskaskade auslösen. Die allgemeinen Stadien in diesem Prozess sind: Erkennung, Differenzierung spezifischer Lymphozyten und schließlich das Effektorstadium.
Struktur
Alle Antikörper sind komplexe Polypeptidmoleküle, die wie ein "Y" geformt sind. Sie bestehen aus vier Polypeptidketten, von denen zwei identische leichte (kurze) Ketten mit jeweils etwa 214 Aminosäuren und die anderen beiden schweren (langen) Ketten ebenfalls identisch sind, doppelt so viele Aminosäuren. Eine Disulfidbindung verbindet eine leichte Kette mit einer schweren Kette.
Beide Arten von Ketten haben konstante Regionen (charakteristisch für die Art des Antikörpers und die Spezies, zu der der Organismus gehört), in denen die Sequenz der Aminosäuren von einem Molekül zum anderen wiederholt wird, und sie haben auch variable Regionen von ungefähr 100 Aminosäuren in Länge..
Eine Disulfidbrücke (kovalente Bindung) verbindet jede leichte Kette mit einer schweren Kette, und wiederum können eine oder zwei dieser Bindungen die beiden schweren Ketten verbinden.
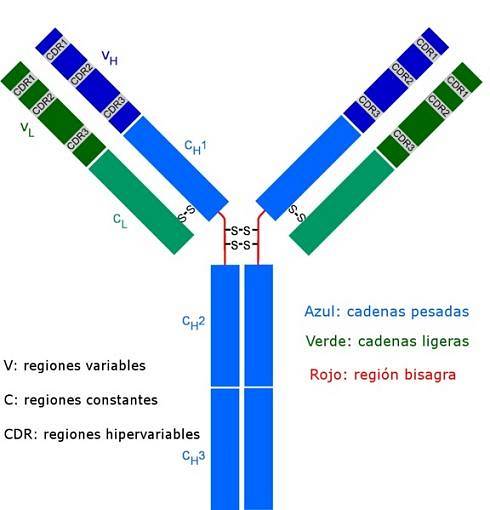
Diese Stellen sind diejenigen, die wie ein Handschuh an eine bestimmte Region des spezifischen Antigens, Epitops oder der Antigendeterminante binden. Die Stabilisierung dieser Wechselwirkung erfolgt dank zahlreicher nichtkovalenter Bindungen.
Diese CDR-Sequenzen sind unter den Antikörpern sehr variabel und erzeugen Spezifität für verschiedene Arten von Antigenen..
In Bezug auf die Besonderheiten von Immunglobulin D ist bekannt, dass es eine große Vielfalt unter Wirbeltieren aufweist. Im Großen und Ganzen besteht es aus zwei schweren Delta-Ketten und zwei leichten Ketten. IgD ist entweder im Serum frei oder über einen Fc-Rezeptor an B-Lymphozyten gebunden..
Funktion und Krankheiten
Da IgD evolutionär von Knorpelfischen (die den Planeten vor etwa 500 Millionen Jahren bevölkerten) für den Menschen konserviert wurde, wird angenommen, dass es lebenswichtige Immunfunktionen erfüllt.
Trotzdem wurde das am wenigsten untersuchte Immunglobulin untersucht, für das die spezifischen Funktionen von sIgD im Serum noch nicht genau bekannt sind, während für mIgD mehrere Funktionen vorgeschlagen wurden.
sIgD
Eine der Ursachen für das jüngste Interesse an der Untersuchung von sIgD war die Feststellung hoher Ig-Spiegel bei einigen Kindern mit periodischem Fieber. Ein weiterer interessanter Faktor ist die Nützlichkeit bei der Überwachung von Myelomen..
Es wird angenommen, dass SIgD eine Rolle im Blut, in den Schleimhautsekreten und auf der Oberfläche von angeborenen Immuneffektorzellen wie Basophilen spielt.
Sie sind hochreaktiv gegen Krankheitserreger der Atemwege und deren Ausscheidungsprodukte. Es wurde berichtet, dass IgD dank seiner Wirkung auf vorhandene Bakterien und Viren die Schleimhautimmunität erhöht.
mIgD
In Bezug auf mIgD wird es als Membranantigenrezeptor für B-Lymphozyten angesehen, der die Zellreifung begünstigen würde. Es wird wiederum angenommen, dass es ein Ligand für IgD-Rezeptoren bei der Immunregulation von T-Helferzellen ist..
B-Lymphozyten
Es wird angenommen, dass IgD-produzierende B-Lymphozyten eine bestimmte Zelllinie darstellen, die als B-1-Lymphozyten bezeichnet wird. Dies sind selbstreaktive Lymphozyten, die der klonalen Deletion entkommen sind.
Die von diesen Lymphozyten erzeugten Autoantikörper reagieren mit Desoxyribonukleinsäure oder DNA (einzel- und doppelsträngig), mit Zellrezeptoren, den Zellmembranen roter Blutkörperchen und Epithelgewebe..
Auf diese Weise erzeugen sie Autoimmunerkrankungen wie systemischen Lupus erythematodes und Myasthenie gravis, Autoimmunhämolytische Anämie und idiopathische Thrombozytopenie purpura.
Immun-Entzündungssystem
Es ist auch bekannt, dass IgDs an der Orchestrierung eines Systems beteiligt sind, das zwischen dem Immunsystem und dem Entzündungssystem stört: Hohe IgD-Konzentrationen stehen im Zusammenhang mit autoinflammatorischen Erkrankungen (Hyperimmunoglobulämie-Syndrom D, HIDS oder Hyper-IgD)..
Beispielsweise werden bei Patienten mit Autoimmunerkrankungen wie rheumatoider Arthritis erhöhte Werte sowohl für sIgD als auch für mIgD gefunden. Es wird daher angenommen, dass dieser Zustand zur Pathogenese der Krankheit beiträgt.
Die möglichen Funktionen dieses Antikörpers in mononukleären Zellen des peripheren Blutes (PBMC) dieser Patienten werden derzeit untersucht. All dies hat zu der Annahme geführt, dass IgD ein potenzielles immuntherapeutisches Ziel bei der Behandlung von rheumatoider Arthritis sein könnte.
Normalwerte
Die sIgD bei normalen Personen variiert stark, was es schwierig gemacht hat, ein genaues Referenzintervall für ihre normalen Konzentrationen festzulegen. Einige Studien haben gezeigt, dass diese Variation besonders beeinflusst wird durch:
- Die Empfindlichkeit der angewandten Detektionstechnik - sowohl durch Radioimmunoassays (RIA) als auch durch Enzymimmunoassays (EIA) und die in klinischen Labors am häufigsten verwendete ist die Radioimmunodiffusion (RID).-.
- Das Fehlen einer einzigen festgelegten universellen Methode zum Nachweis von IgD.
- Erbliche Faktoren, Rasse, Alter, Geschlecht, Schwangerschaftsstatus, Raucherstatus ua
Einige Spezialisten sind sogar der Ansicht, dass die Routineanalyse von IgD nicht gerechtfertigt ist, da ihre spezifische Rolle noch lange nicht geklärt ist und die Kosten für die Analyse im klinischen Labor hoch sind. Dies wäre nur bei Patienten mit monoklonaler IgD im Serum oder bei Verdacht auf HIDS gerechtfertigt.
Serumkonzentration
Andererseits ist bekannt, dass sIgD im Allgemeinen eine Serumkonzentration aufweist, die niedriger als die von IgG, IgA und IgM ist, jedoch höher als die Konzentration von IgE..
Da es eine Halbwertszeit von 2 bis 3 Tagen hat, beträgt die Plasmakonzentration weniger als 1% des gesamten Immunglobulins im Serum. Einige Untersuchungen zeigen, dass es 0,25% der gesamten Immunglobuline im Serum ausmacht.
Blutwerte
Unter den gemeldeten sIgD-Werten im Blut lag sie bei Neugeborenen bei 0,08 mg / l (bestimmt durch RIA), bei Säuglingen und Erwachsenen zwischen nicht nachweisbaren Werten und 400 mg / l (je nach Alter und Individuum) Individuell).
Bei normalen Erwachsenen wurden sie als normale Durchschnittswerte angegeben 25; 35; 40 und 50 mg / l. Im Allgemeinen wurde die mittlere Serumkonzentration für gesunde Erwachsene mit 30 mg / l angegeben (bestimmt durch RID)..
Wie in diesem Artikel erläutert, gibt es jedoch zahlreiche Faktoren, die die Festlegung eines Bereichs von Standardnormalwerten verhindern..
Verweise
- Chen, K. und Cerutti, A. (2011). Die Funktion und Regulation von Immunglobulin D.. Aktuelle Meinung in der Immunologie, 23 (3), 345 & ndash; 52.
- Harfi, A. H. und Godwin, J.T. (1985). Normale Serumspiegel von IgG, IgA, IgM, IgD und IgE in Saudi-Arabien. Annals of Saudi Medicine, Band 5, Nr. 2.99-104. doi: 10.5144 / 0256-4947.1985.99
- Josephs, S.H. und Buckley, R.H. (1980). Serum-IgD-Konzentrationen bei normalen Säuglingen, Kindern und Erwachsenen sowie bei Patienten mit erhöhtem IgE. The Journal of Pediatrics, Bd. 96, Nr. 3, S. 417-420.
- Vladutiu, A.O. (2000). Immunglobulin D: Eigenschaften, Messung und klinische Relevanz. Klinische und diagnostische Laborimmunologie, 7(2), 131 & ndash; 40.
- Voet, J.G. und Voet, W.P.D. (2005). Grundlagen der Biochemie: Lyfe auf molekularer Ebene. Wiley. S. 1361.
- Wu, Y., Chen, W., Chen, H., Zhang, L., Chang, Y., Yan, S., Dai, X., Ma, Y., Huang, Q. und Wei, W. ( 2016). Das erhöhte sekretierte Immunglobulin D verstärkte die Aktivierung von mononukleären Zellen des peripheren Blutes bei rheumatoider Arthritis. PloS eins, 11 (1). doi: 10.1371 / journal.pone.0147788



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.