
Struktur, Synthese, Wirkmechanismus der Steroidhormone
Das Steroide Es handelt sich um Substanzen, die von Drüsen der inneren Sekretion hergestellt werden und direkt in den Kreislauf gelangen, der sie zu den Geweben führt, in denen sie ihre physiologischen Wirkungen ausüben. Sein Gattungsname leitet sich von der Tatsache ab, dass es in seiner Grundstruktur einen Steroidkern hat..
Cholesterin ist die Vorläufersubstanz, aus der alle Steroidhormone synthetisiert werden, die in Progestagene (z. B. Progesteron), Östrogene (Östron), Androgene (Testosteron), Glukokortikoide (Cortisol), Mineralocorticoide (Aldosteron) und Vitamin D eingeteilt sind.
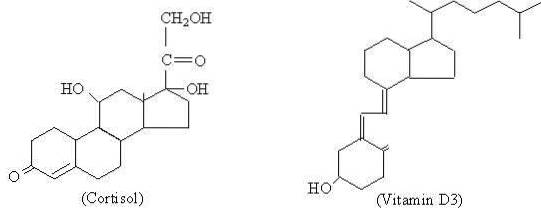
Obwohl die verschiedenen Steroidhormone molekulare Unterschiede zwischen ihnen aufweisen, die ihnen ihre unterschiedlichen funktionellen Eigenschaften verleihen, kann gesagt werden, dass sie eine ihnen gemeinsame Grundstruktur haben, die durch das Cyclopentanperhydrophenanthren mit 17 Kohlenstoffatomen dargestellt wird.
Artikelverzeichnis
- 1 Struktur von Steroiden
- 1.1 C21
- 1.2 C19
- 1.3 C18
- 2 Synthese
- 2.1 - Synthese auf der Ebene der Nebennierenrinde
- 2.2 - Androgensynthese
- 2.3 - Synthese männlicher Sexualsteroide in den Hoden
- 2.4 - Synthese weiblicher Sexualsteroide in den Eierstöcken
- 3 Wirkmechanismus
- 4 Aldosteron als Beispiel
- 5 Referenzen
Struktur von Steroiden
Steroide sind organische Verbindungen sehr unterschiedlicher Natur, die einen gemeinsamen Kern gemeinsam haben, der aus der Fusion von drei Ringen mit sechs Kohlenstoffatomen (Cyclohexanen) und einem von fünf Kohlenstoffatomen (Cyclopentan) besteht..
Diese Struktur ist auch als "Cyclopentanperhydrophenanthren" bekannt. Da die Ringe miteinander verbunden sind, beträgt die Gesamtzahl der Kohlenstoffatome, aus denen sie bestehen, 17; Die meisten natürlichen Steroide weisen jedoch Methylgruppen an den Kohlenstoffen 13 und 10 auf, die die Kohlenstoffe 18 bzw. 19 darstellen..

Viele der natürlichen Steroidverbindungen haben auch eine oder mehrere Gruppen mit alkoholischer Funktion in der Ringstruktur und werden daher als Sterole bezeichnet. Unter diesen befindet sich Cholesterin, das eine Alkoholfunktion an Kohlenstoff 3 und eine Kohlenwasserstoffseitenkette von 8 Kohlenstoffatomen hat, die an Kohlenstoff 17 gebunden sind; Atome, die von 20 bis 27 nummeriert sind.
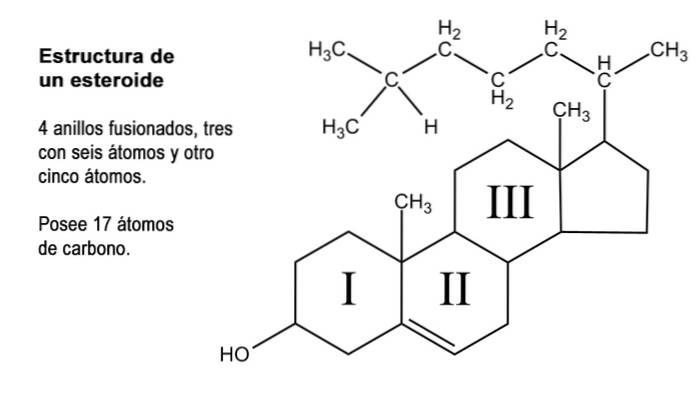
Zusätzlich zu diesen 17 Kohlenstoffen können Steroidhormone 1, 2 oder 4 weitere dieser Atome in ihrer Struktur aufweisen, für die drei Arten von Steroiden erkannt werden, nämlich: C21, C19 und C18.
C21
Die C21 werden wie Progesteron und Nebennierenrindenkortikosteroide (Glukokortikoide und Mineralokortikoide) von „Pregnan“ abgeleitet. Es hat 21 Kohlenstoffatome, weil zu den 17 des basischen Rings die beiden Methylgruppen der Kohlenstoffe 13 und 10 und zwei Kohlenstoffe der an C17 gebundenen Seitenkette hinzugefügt werden, die ursprünglich in Cholesterin 8 Kohlenstoffe betrugen.
C19
Die C19 entsprechen Sexualhormonen mit androgener Aktivität und stammen von „Androstan“ (19 Kohlenstoffatome). Dies ist die Struktur, die verbleibt, wenn Pregnan die beiden Kohlenstoffe der C17-Seitenkette verliert, die durch eine Hydroxyl- oder eine Ketongruppe ersetzt wird.
C18
C18-Steroide sind weibliche Hormone oder Östrogene, die hauptsächlich in den weiblichen Gonaden synthetisiert werden und deren herausragende Eigenschaft in Bezug auf die beiden anderen Steroidtypen das Fehlen des in letzteren an das Kohlenstoff in Position 10 gebundenen Methyls ist.
Während der Synthese aus Cholesterin werden enzymatische Modifikationen erzeugt, die die Anzahl der Kohlenstoffe verändern und Dehydrierungen und Hydroxylierungen spezifischer Kohlenstoffe der Struktur fördern..
Synthese
Die Zellen, die Steroidhormone produzieren, befinden sich hauptsächlich in der Nebennierenrinde, wo Glukokortikoide wie Cortisol, Mineralokortikoide wie Aldosteron und männliche Sexualhormone wie Dehydroepiandrosteron und Androstendion produziert werden..
Männliche Sexualgonaden sind für die Produktion von Androgenen verantwortlich, einschließlich der oben genannten Hormone und Testosteron, während die reifenden Ovarialfollikel Progesteron und Östrogene produzieren..
Die Synthese aller Steroidhormone beginnt mit Cholesterin. Dieses Molekül kann von Zellen synthetisiert werden, die Steroidhormone produzieren, aber zum größten Teil wird es von diesen Zellen aus Lipoproteinen niedriger Dichte (LDL) erhalten, die im zirkulierenden Plasma vorhanden sind..
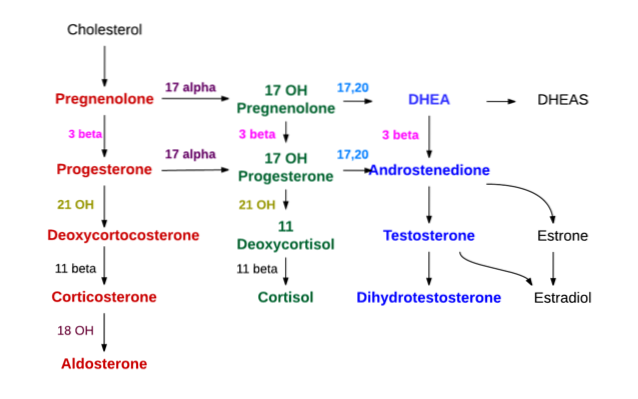
- Synthese auf der Ebene der Nebennierenrinde
In der Nebennierenrinde werden drei Schichten unterschieden, die von außen als glomeruläre, faszikuläre bzw. retikuläre Zonen bekannt sind..
In den glomerulären werden hauptsächlich Mineralocorticoide (Aldosteron) synthetisiert, in den faszikulären Glucocorticoiden wie Corticosteron und Cortisol und in den retikulären Androgenen wie Dehydroepiandrosteron und Androstendion.
Glukokortikoidsynthese
Der erste Syntheseschritt findet in den Mitochondrien statt und besteht aus der Wirkung eines Enzyms namens Cholesterin-Desmolase, das zur Cytochrom-P450-Superfamilie gehört und auch als "P450scc" oder "CYP11A1" bekannt ist und die Eliminierung von 6 der Kohlenstoffatome fördert der an C17 angebrachten Seitenkette.
Durch die Wirkung von Desmolase wird Cholesterin (mit 27 Kohlenstoffatomen) in Pregnenolon umgewandelt, eine Verbindung mit 21 Kohlenstoffatomen, die das erste Steroid des C21-Typs darstellt.
Pregnenolon wandert zum glatten endoplasmatischen Retikulum, wo durch die Wirkung des Enzyms 3β-Hydroxysteroid-Dehydrogenase in der Hydroxylgruppe der Alkoholgruppe von Kohlenstoff 3 eine Dehydrierung eingeht und Progesteron wird.
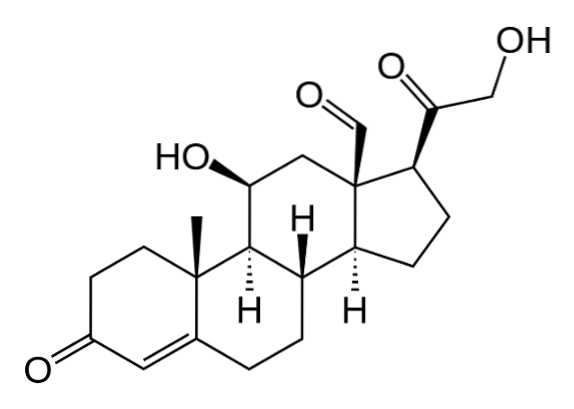
Aufgrund der Wirkung von 21β-Hydroxylase, auch "P450C21" oder "CYP21A2" genannt, wird Progesteron an Kohlenstoff 21 hydroxyliert und in 11-Desoxycorticosteron umgewandelt, das in die Mitochondrien zurückkehrt und zu dem das Enzym 11β-Hydroxylase ("P450C11") gehört "Oder" CYP11B1 ") wandelt sich in Corticosteron um.
Eine andere Syntheselinie in der Faszikelzone, die nicht in Corticosteron, sondern in Cortisol endet, tritt auf, wenn Pregnenolon oder Progesteron in Position 17 durch 17α-Hydroxylase ("P450C17" oder "CYP17") hydroxyliert und 17-Hydroxypregnolon oder 17-Hydroxyprogesteron umgewandelt werden.
Das gleiche bereits erwähnte Enzym, die 3β-Hydroxysteroid-Dehydrogenase, die Pregnenolon in Progesteron umwandelt, wandelt auch 17-Hydroxypregnolon in 17-Hydroxyprogesteron um.
Letzteres wird nacheinander von den letzten beiden Enzymen des Weges übertragen, der Corticosteron (21β-Hydroxylase und 11β-Hydroxylase) zu Desoxycortisol bzw. Cortisol produziert..
Glukokortikoidwirkungen
Die Hauptglukokortikoide, die in der Zona fascicular der Nebennierenrinde produziert werden, sind Corticosteron und Cortisol. Beide Substanzen, insbesondere Cortisol, zeigen ein breites Wirkungsspektrum, das den Stoffwechsel, das Blut, die Abwehr- und Wundheilungsreaktionen, die Knochenmineralisierung, den Verdauungstrakt, das Kreislaufsystem und die Lunge beeinflusst..
In Bezug auf den Stoffwechsel stimuliert Cortisol die Lipolyse und die Freisetzung von Fettsäuren, die in der Leber zur Bildung von Ketonkörpern und Proteinen niedriger Dichte (LDL) verwendet werden können. verringert die Glukoseaufnahme und Lipogenese im Fettgewebe sowie die Glukoseaufnahme und -verwertung im Muskel.
Es fördert auch den Proteinkatabolismus in der Peripherie: im Bindegewebe, in der Muskel- und Knochenmatrix, wodurch Aminosäuren freigesetzt werden, die in der Leber zur Synthese von Plasmaproteinen und zur Glukoneogenese verwendet werden können. Es stimuliert zusätzlich die intestinale Glukoseabsorption, indem es die Produktion von SGLT1-Transportern erhöht..
Eine beschleunigte intestinale Glukoseabsorption, eine erhöhte Leberproduktion und eine verringerte Verwendung dieses Kohlenhydrats in Muskel- und Fettgewebe begünstigen eine Erhöhung des Plasmaglukosespiegels..
Im Blut begünstigt Cortisol den Gerinnungsprozess, stimuliert die Bildung von neutrophilen Granulozyten und hemmt die Bildung von Eosinophilen, Basophilen, Monozyten und T-Lymphozyten. Es hemmt auch die Freisetzung von Entzündungsmediatoren wie Prostaglandinen, Interleukinen, Lymphokinen, Histamin und Serotonin.
Allgemein kann gesagt werden, dass Glukokortikoide die Immunantwort stören, weshalb sie in den Fällen therapeutisch eingesetzt werden können, in denen diese Reaktion übertrieben oder unangemessen ist, wie im Fall von Autoimmunerkrankungen oder bei Organtransplantationen, um sie zu reduzieren Ablehnung.
- Androgensynthese
Die Androgensynthese auf der Ebene der Nebennierenrinde erfolgt hauptsächlich auf der Ebene der retikulären Zone und aus 17-Hydroxypregnolon und 17-Hydroxyprogesteron.
Das gleiche 17α-Hydroxylase-Enzym, das die beiden gerade genannten Substanzen produziert, hat auch eine 17,20-Lyase-Aktivität, die die beiden Kohlenstoffe der C17-Seitenkette entfernt und durch eine Ketogruppe (= O) ersetzt..
Diese letzte Aktion reduziert die Kohlenstoffzahl um zwei und produziert Steroide vom Typ C19. Wenn die Wirkung auf 17-Hydroxypregnolon erfolgt, ist das Ergebnis Dehydroepiandrosteron; Wenn im Gegenteil die betroffene Substanz Hydroxyprogesteron ist, ist das Produkt Androstendion.
Beide Verbindungen sind Teil der sogenannten 17-Ketosteroide, da sie am Kohlenstoff 17 eine Ketongruppe aufweisen.
3β-Hydroxysteroid-Dehydrogenase wandelt auch Dehydroepiandrosteron in Androstendion um, aber das häufigste ist, dass das erstere durch eine Sulfokinase, die fast ausschließlich in der retikulären Zone vorhanden ist, in Dehydroepiandrosteronsulfat umgewandelt wird.
Synthese von Mineralocorticoiden (Aldosteron)
Der Zona glomerularis fehlt das 17α-Hydroxylase-Enzym und sie kann die 17-Hydroxysteroid-Vorläufer von Cortisol und Sexualhormonen nicht synthetisieren. Es hat auch keine 11β-Hydroxylase, aber es hat ein Enzym namens Aldosteronsynthetase, das nacheinander Corticosteron, 18-Hydroxycorticosteron und das Mineralocorticoid Aldosteron produzieren kann..
Wirkungen von Mineralocorticoiden
Das wichtigste Mineralocorticoid ist Aldosteron, das in der Zona glomerularis der Nebennierenrinde synthetisiert wird. Glucocorticoide weisen jedoch auch eine Mineralocorticoidaktivität auf.
Die Mineralocorticoid-Aktivität von Aldosteron entwickelt sich auf der Ebene des tubulären Epithels des distalen Nephrons, wo es die Natriumresorption (Na +) und die Kaliumsekretion (K +) fördert und so zur Erhaltung der Konzentrationen dieser Ionen in den Körperflüssigkeiten beiträgt.
- Synthese männlicher Sexualsteroide in den Hoden
Die testikuläre Androgensynthese erfolgt auf der Ebene der Leydig-Zellen. Testosteron ist das wichtigste Androgenhormon, das in den Hoden produziert wird. Seine Synthese beinhaltet die anfängliche Produktion von Androstendion, wie zuvor für die Synthese von Androgenen auf der Ebene der Nebennierenrinde beschrieben..
Androstendion wird durch die Wirkung des Enzyms 17β-Hydroxysteroid-Dehydrogenase, das die Ketongruppe von Kohlenstoff 17 durch eine Hydroxylgruppe (OH) ersetzt, in Testosteron umgewandelt..
In einigen Geweben, die als Ziel für Testosteron dienen, wird es durch eine 5α-Reduktase zu Dihydrotestosteron mit größerer androgener Kraft reduziert.
- Synthese weiblicher Sexualsteroide in den Eierstöcken
Diese Synthese erfolgt zyklisch und begleitet die Veränderungen, die während des weiblichen Sexualzyklus auftreten. Die Synthese findet im Follikel statt, der während jedes Zyklus reift, um ein Ei freizusetzen und dann das entsprechende Corpus luteum zu produzieren.
Östrogene werden in den körnigen Zellen des reifen Follikels synthetisiert. Der reife Follikel hat Zellen in seinem Theka, die Androgene wie Androstendion und Testosteron produzieren..
Diese Hormone diffundieren in benachbarte Granulosazellen, die das Aromataseenzym besitzen, das sie in Östron (E1) und 17β-Östradiol (E2) umwandelt. Aus beiden wird Östriol synthetisiert.
Aktionen von Sexualsteroiden
Androgene und Östrogene haben als Hauptfunktion die Entwicklung männlicher bzw. weiblicher Geschlechtsmerkmale. Androgene haben anabole Wirkungen, die die Synthese von Strukturproteinen fördern, während Östrogene den Ossifikationsprozess begünstigen.
Die Östrogene und Progesterone, die während des weiblichen Sexualzyklus freigesetzt werden, sollen den Körper der Frau auf eine mögliche Schwangerschaft infolge der Befruchtung des reifen Eies vorbereiten, das während des Eisprungs freigesetzt wird..
Wirkmechanismus
Wenn Sie Ihr Gedächtnis über den Wirkungsmechanismus von Hormonen auffrischen müssen, wird empfohlen, das folgende Video anzusehen, bevor Sie mit dem Lesen fortfahren.
Der Wirkungsmechanismus von Steroidhormonen ist bei allen sehr ähnlich. Bei lipophilen Verbindungen lösen sie sich problemlos in der Lipidmembran auf und dringen in das Zytoplasma ihrer Zielzellen ein, die spezifische zytoplasmatische Rezeptoren für das Hormon haben, auf das sie reagieren müssen..
Sobald der Hormon-Rezeptor-Komplex gebildet ist, passiert er die Kernmembran und bindet im Genom wie ein Transkriptionsfaktor an ein Hormon-Response-Element (HRE) oder ein primäres Response-Gen, das wiederum manchmal andere Gene regulieren kann sekundäre Antwort genannt.
Das Endergebnis ist die Förderung der Transkription und die Synthese von Messenger-RNAs, die in die Ribosomen des rauen endoplasmatischen Retikulums übersetzt werden und letztendlich die durch das Hormon induzierten Proteine synthetisieren..
Aldosteron als Beispiel
Die Wirkung von Aldosteron wird hauptsächlich auf der Ebene des letzten Teils des distalen Röhrchens und in den Sammelkanälen ausgeübt, wo das Hormon die Na + -Reabsorption und die K-Sekretion fördert+.
In der Luminalmembran der Hauptröhrenzellen dieser Region befinden sich epitheliale Na + -Kanäle und K + -Kanäle vom Typ "ROMK". Nierenaußenmark Kaliumkanal).
Die basolaterale Membran verfügt über Na + / K + ATPase-Pumpen, die kontinuierlich Na + aus der Zelle in den basolateralen Zwischenraum ziehen und K + in die Zelle einführen. Diese Aktivität hält die intrazelluläre Konzentration von Na + sehr niedrig und begünstigt die Erzeugung eines Konzentrationsgradienten für dieses Ion zwischen dem Lumen des Tubulus und der Zelle..
Dieser Gradient ermöglicht es Na +, sich durch den Epithelkanal in Richtung der Zelle zu bewegen, und da Na + alleine passiert, bleibt für jedes sich bewegende Ion eine nicht kompensierte negative Ladung übrig, die bewirkt, dass das Lumen des Tubulus in Bezug auf das Interstitium negativ wird. Das heißt, mit dem negativen Licht wird eine transepitheliale Potentialdifferenz erzeugt.
Diese Negativität des Lichts begünstigt den Austritt von K +, der sich durch seine höhere Konzentration in der Zelle bewegt, und die Negativität des Lichts wird in Richtung des Lumens des Tubulus ausgeschieden, um schließlich ausgeschieden zu werden. Es ist diese Na + -Reabsorption und K + -Sekretionsaktivität, die durch die Wirkung von Aldosteron reguliert wird..
Aldosteron, das im Blut vorhanden ist und als Reaktion auf die Wirkung von Angiotensin II oder auf Hyperkaliämie aus der Zona glomerularis freigesetzt wird, dringt in die Hauptzellen ein und bindet an seinen intrazytoplasmatischen Rezeptor.
Dieser Komplex erreicht den Kern und fördert die Transkription von Genen, deren Expression die Synthese und Aktivität von Na + / K + -Pumpen, epithelialen Na + -Kanälen und ROMK K + -Kanälen sowie anderen Proteinen erhöht. Eine Reaktion, die den Gesamteffekt der Beibehaltung von Na + im Körper und der Erhöhung der K-Ausscheidung im Urin hat+.
Verweise
- Ganong WF: The Adrenal Medulla & Adrenal Cortex, 25. Ausgabe. New York, McGraw-Hill Education, 2016.
- Guyton AC, Halle JE: Nebennierenrindenhormone, in Lehrbuch der Medizinischen Physiologie , 13. Ausgabe, AC Guyton, JE Hall (Hrsg.). Philadelphia, Elsevier Inc., 2016.
- Lang F, Verrey F: Hormon, in Physiologie des Menschen mit Pathophysiologie, 31. Auflage, RF Schmidt et al. (Hrsg.). Heidelberg, Springer Medizin Verlag, 2010.
- Voigt K: Endokrines System, In: Physiologie, 6. Auflage; R. Klinke et al. (Hrsg.). Stuttgart, Georg Thieme Verlag, 2010.
- Widmaier EP, Raph H und Strang KT: Weibliche Reproduktionsphysiologie, in Vander's Human Physiology: Die Mechanismen der Körperfunktion, 13. Ausgabe; EP Widmaier et al. (Hrsg.). New York, McGraw-Hill, 2014.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.