
Histoneigenschaften, Struktur, Typen und Funktionen
Das Histone sind Grundproteine, die mit DNA zur Bildung von Nukleosomen interagieren, die die Chromatinstränge bilden, aus denen Chromosomen in eukaryotischen Organismen bestehen.
Nucleosomen, Komplexe aus DNA und Proteinen, wurden 1974 entdeckt, und es sind Histone, die diese grundlegende Ebene der Chromatinorganisation bilden. Die Existenz von Histonproteinen ist jedoch bereits vor den 1960er Jahren bekannt..
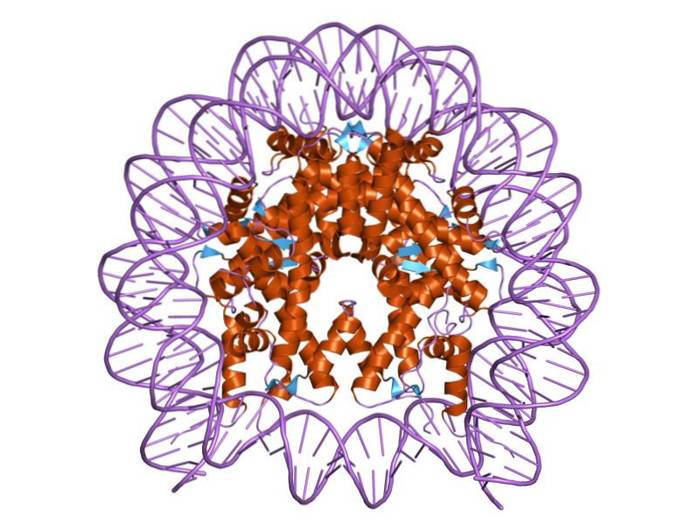
Histone sind so organisiert, dass sich die Doppelband-DNA um ein Proteinzentrum wickelt, das aus diesen Proteinen besteht, die eng miteinander interagieren. Das Histonzentrum ist wie eine Scheibe geformt und wird von der DNA etwa 1,7-mal umgangen..
Mehrere Wasserstoffbrückenbindungen ermöglichen es der DNA, an das Proteinzentrum zu binden, das von den Histonen in jedem Nukleosom gebildet wird. Diese Bindungen werden größtenteils zwischen dem Aminosäurerückgrat von Histonen und dem Zucker-Phosphat-Rückgrat von DNA gebildet. Einige hydrophobe Wechselwirkungen und Ionenbindungen sind ebenfalls beteiligt.
Proteine, die als "Chromatin-Remodeling-Komplexe" bekannt sind, sind für den Abbau und die Bildung der Verbindungsbindungen zwischen DNA und Histonen verantwortlich und ermöglichen den Eintritt der Transkriptionsmaschinerie in die in den Nukleosomen enthaltene DNA.
Trotz der Nähe von Nukleinsäuren zu dem durch Histone gebildeten Proteinzentrum sind diese so angeordnet, dass sie bei Bedarf den Eintritt von Transkriptionsfaktoren und anderen Proteinen ermöglichen, die mit der Genexpression oder der Gen-Stummschaltung zusammenhängen..
Histone können verschiedene Modifikationen erfahren, die mehrere Varianten erzeugen, wodurch die Existenz vieler verschiedener Formen von Chromatin ermöglicht wird, die die Eigenschaft haben, die genetische Expression auf unterschiedliche Weise zu modulieren..
Artikelverzeichnis
- 1 Funktionen
- 2 Struktur
- 2.1 Bindungshistone
- 3 Typen
- 3.1 Nucleosomale Histone
- 3.2 Histone binden
- 4 Funktionen
- 5 Referenzen
Eigenschaften
Sie sind eines der am besten konservierten eukaryotischen Proteine in der Natur. Beispielsweise wurde gezeigt, dass sich Erbsenhiston H4 in nur zwei der 102 Aminosäurepositionen des Kuh-H4-Proteins unterscheidet..
Histone sind relativ kleine Proteine mit nicht mehr als 140 Aminosäuren. Sie sind reich an basischen Aminosäureresten, haben also eine positive Nettoladung, die zu ihrer Wechselwirkung mit der negativ geladenen Nukleinsäure unter Bildung von Nukleosomen beiträgt..
Nucleosomale und verbrückende Histone sind bekannt. Die nukleosomalen Histone sind H3, H4, H2A und H2B, während die Bindungshistone zur Familie der Histone H1 gehören.
Während des Zusammenbaus der Nukleosomen werden zunächst spezifische Dimere H3-H4 und H2A-H2B gebildet. Zwei H3-H4-Dimere verbinden sich dann zu Tetrameren, die sich später mit den H2A-H2B-Dimeren verbinden und das oktamere Zentrum bilden..
Alle Histone werden hauptsächlich während der S-Phase des Zellzyklus synthetisiert, und die Nukleosomen werden unmittelbar nach der Replikationsgabel in den entstehenden DNA-Helices zusammengesetzt..
Struktur
Die allgemeine Struktur von Histonen umfasst eine basische Aminosäureregion und eine globuläre Carboxylregion, die unter eukaryotischen Organismen hoch konserviert sind..
Ein als "Histonfalte" bekanntes Strukturmotiv, das aus drei Alpha-Helices besteht, die durch zwei Haarnadeln verbunden sind und ein kleines hydrophobes Zentrum bilden, ist für die Protein-Protein-Wechselwirkungen zwischen den Histonen verantwortlich, aus denen das Nukleosom besteht..
Es ist diese Histonfalte, die die globuläre Carboxyldomäne dieser nukleosomalen Proteine in allen Eukaryoten ausmacht..
Histone haben auch kleine "Schwänze" oder aminoterminale und andere carboxylterminale Regionen (für Proteasen zugänglich), die nicht länger als 40 Aminosäuren sind. Beide Regionen sind reich an basischen Aminosäuren, die mehrere posttranslationale kovalente Modifikationen erfahren können..
Bindungshistone
In Eukaryoten gibt es zwei Familien von Bindungshistonen, die sich durch ihre Struktur voneinander unterscheiden. Einige haben eine dreigliedrige Struktur, wobei die oben beschriebene globuläre Domäne von "unstrukturierten" N- und C-terminalen Domänen flankiert wird; während andere nur eine C-terminale Domäne haben.
Obwohl die meisten Histone konserviert sind, können bestimmte Varianten während der Embryogenese oder Reifung spezialisierter Zellen in einigen Organismen auftreten. Einige strukturelle Variationen haben mit posttranslationalen Modifikationen zu tun, wie zum Beispiel den folgenden:
-Phosphorylierung: Es wird angenommen, dass es mit der Modifikation des Kondensationsgrades von Chromatin zusammenhängt, und es kommt häufig in Serinresten vor.
-Acetylierung: assoziiert mit chromosomalen Regionen, die transkriptionell aktiv sind. Es tritt normalerweise an den Seitenketten von Lysinresten auf. Wenn sie an diesen Resten auftreten, nimmt ihre positive Ladung ab, wodurch die Affinität von Proteinen zur DNA verringert wird..
-Methylierung: kann als Mono-, Di- oder Trimethylierung von Lysinresten auftreten, die aus dem Proteinkern herausragen.
Spezifische Enzyme sind für diese kovalenten Modifikationen in Histonen verantwortlich. Diese Enzyme umfassen Histon-Acetyl-Transferasen (HATs), Histon-Deacetylase-Komplexe (HDACs) sowie Histon-Methyltransferasen und -Demethylasen..
Typen
Die Charakterisierung der Histone wurde mit verschiedenen biochemischen Techniken durchgeführt, unter denen sich die Chromatographien hervorheben, die auf schwachen Kationenaustauscherharzen beruhen..
Bestimmte Autoren legen eine Form der Klassifizierung fest, bei der 5 Haupttypen von Histonen in Eukaryoten unterschieden werden: FI mit 21 kDa-Proteinen; F2A1 oder FIV von plus oder minus 11,3 kDa; F2A2 oder FIIbI, 14,5 kDa; F2B oder FIIb2 mit einem Molekulargewicht von 13,7 kDa und F3 oder FIII mit 15,3 kDa.
Alle diese Arten von Histonen mit Ausnahme der IF-Gruppe kommen in äquimolaren Mengen in Zellen vor..
Eine andere Klassifikation mit der gleichen Gültigkeit und vielleicht der heute am weitesten verbreiteten schlägt die Existenz von zwei verschiedenen Arten von Histonen vor, nämlich diejenigen, die Teil des Oktamers des Nukleosoms sind, und die Bindungs- oder Brückenhistone, die die Nukleosomen zwischen Ja verbinden.
Einige Varianten können auch zwischen Spezies auftreten und im Gegensatz zu Kernhistonen werden Varianten während der Interphase synthetisiert und durch einen Prozess in das vorgeformte Chromatin eingefügt, der von der durch die ATP-Hydrolyse freigesetzten Energie abhängt..
Nucleosomale Histone
Das Zentrum eines Nukleosoms besteht aus einem Paar der vier konstituierenden Histone: H2a, H2b, H3 und H4; auf die DNA-Segmente von etwa 145 Basenpaaren gewickelt sind.
Die Histone H4 und H2B sind grundsätzlich unveränderlich. Einige Variationen sind jedoch bei den Histonen H3 und H2A erkennbar, deren biophysikalische und biochemische Eigenschaften die normale Natur des Nukleosoms verändern..
Das H2A.Z-Protein ist eine Variante des Histons H2A beim Menschen und weist eine große saure Region auf. Je nach den Histon-H3-Varianten, mit denen es assoziiert ist, kann es die Stabilität der Nukleosomen fördern..
Diese Histone zeigen eine gewisse Variabilität zwischen den Spezies, ein Sonderfall ist der des Histons H2B, für das das erste Drittel des Moleküls sehr variabel ist..
Bindungshistone
Die Bindungs- oder Brückenhistone sind Histone der Klasse H1. Diese sind verantwortlich für die Vereinigung der Nukleosomen und den Schutz der DNA, die am Anfang und am Ende jedes Partikels hervorsteht..
Im Gegensatz zu nukleosomalen Histonen besitzen nicht alle Histone vom H1-Typ die globuläre Region der Histonfalte. Diese Proteine binden an DNA zwischen Nukleosomen und erleichtern so transkriptionell eine Verschiebung des Chromatin-Gleichgewichts in Richtung eines kondensierteren und weniger aktiven Zustands..
Studien haben diese Histone mit Alterung, DNA-Reparatur und apoptotischen Prozessen in Verbindung gebracht, weshalb angenommen wird, dass sie eine entscheidende Rolle bei der Aufrechterhaltung der genomischen Integrität spielen.
Eigenschaften
Alle Aminosäurereste von Histonen sind auf die eine oder andere Weise an ihrer Wechselwirkung mit DNA beteiligt, was die Tatsache erklärt, dass sie unter den Reichen eukaryotischer Organismen so konserviert sind.
Die Beteiligung von Histonen an der Verpackung von DNA in Form von Chromatin ist von großer Relevanz für komplexe mehrzellige Organismen, auf die sich die verschiedenen Zelllinien nur spezialisieren können, indem sie die Zugänglichkeit ihrer Gene für die Transkriptionsmaschinerie ändern..
Transkriptionsaktive Genomregionen sind in Nukleosomen dicht, was darauf hindeutet, dass die Assoziation von DNA mit Histonproteinen für die negative oder positive Regulation ihrer Transkription entscheidend ist..
Ebenso hängt die Reaktion auf eine große Anzahl von internen und externen Stimuli während des gesamten Lebens einer Zelle von kleinen Änderungen des Chromatins ab, die normalerweise mit dem Umbau und der posttranslationalen Modifikation der Histone zu tun haben, die in enger Beziehung zu stehen DNA.
Mehrere Histonvariablen erfüllen in Eukaryoten unterschiedliche Funktionen. Eine davon hat mit der Beteiligung einer Variante von Histon H3 an der Bildung der zentromeren Strukturen zu tun, die für die Segregation der Chromosomen während der Mitose verantwortlich sind..
Es wurde gezeigt, dass das Gegenstück dieses Proteins in anderen Eukaryoten für den Aufbau des Proteinkinetochors, an den Spindel-Mikrotubuli während Mitose und Meiose binden, wesentlich ist..
Verweise
- B. Alberts, A. Johnson, J. Lewis, D. Morgan, M. Raff, K. Roberts & P. Walter (2015). Molekularbiologie der Zelle (6. Aufl.). New York: Garland Science.
- Campos, E. I. & Reinberg, D. (2009). Histone: Annotating Chromatin. Annu. Rev. Genet., 43, 559-599.
- Harvey, A. C. & Downs, J. A. (2004). Welche Funktionen bieten Linker-Histone?? Molekulare Mikrobiologie, 53, 771-775.
- Henikoff, S. & Ahmad, K. (2005). Zusammenbau von Histonvarianten zu Chromatin. Annu. Rev. Cell. Dev. Biol., einundzwanzig, 133-153.
- Isenberg, I. (1979). Histone. Annu. Rev. Biochem., 48, 159-191.
- Kornberg, R. D. & Thomas, J. O. (1974). Chromatinstruktur: Oligomere der Histone. Wissenschaft, 184(4139), 865 & ndash; 868.
- Smith, E., DeLange, R. & Bonner, J. (1970). Chemie und Biologie der Histone. Physiologische Bewertungen, fünfzig(2), 159-170.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.