
Hydroxideigenschaften, Nomenklatur und Beispiele

Das Hydroxide sind anorganische und ternäre Verbindungen, die aus der Wechselwirkung zwischen einem Metallkation und der funktionellen Gruppe OH (Hydroxidanion, OH) bestehen-). Die meisten von ihnen sind ionischer Natur, können aber auch kovalente Bindungen aufweisen.
Beispielsweise kann ein Hydroxid als elektrostatische Wechselwirkung zwischen dem Kation M dargestellt werden+ und das OH-Anion-, oder als kovalente Bindung durch die M-OH-Bindung (unteres Bild). Im ersten Fall tritt die Ionenbindung auf, im zweiten Fall die kovalente. Diese Tatsache hängt im wesentlichen vom Metall oder Kation M ab+, sowie seine Ladung und Ionenradius.
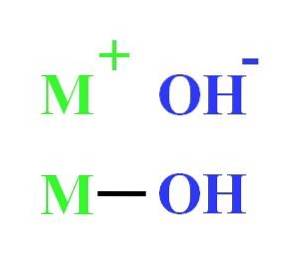
Da die meisten von ihnen aus Metallen stammen, ist es gleichbedeutend, sie als Metallhydroxide zu bezeichnen.
Artikelverzeichnis
- 1 Wie entstehen sie??
- 2 Eigenschaften von Hydroxiden
- 2,1 OH-Anion-
- 2.2 Ionischer und grundlegender Charakter
- 2.3 Periodischer Trend
- 2.4 Amphoterismus
- 2.5 Strukturen
- 2.6 Dehydratisierungsreaktion
- 3 Nomenklatur
- 3.1 Traditionell
- 3.2 Lager
- 3.3 Systematik
- 4 Beispiele für Hydroxide
- 5 Referenzen
Wie entstehen sie??
Es gibt zwei Hauptsynthesewege: durch Umsetzen des entsprechenden Oxids mit Wasser oder mit einer starken Base in einem sauren Medium:
MO + H.zweiO => M (OH)zwei
MO + H.+ + Oh- => M (OH)zwei
Nur die wasserlöslichen Metalloxide reagieren direkt unter Bildung des Hydroxids (erste chemische Gleichung). Andere sind unlöslich und erfordern saure Spezies, um M freizusetzen+, welches dann mit dem OH interagiert- von starken Basen (zweite chemische Gleichung).
Diese starken Basen sind jedoch Metallhydroxide NaOH, KOH und andere aus der Gruppe der Alkalimetalle (LiOH, RbOH, CsOH). Dies sind ionische Verbindungen, die in Wasser gut löslich sind, daher ihr OH- sind frei, an chemischen Reaktionen teilzunehmen.
Andererseits gibt es Metallhydroxide, die unlöslich sind und folglich sehr schwache Basen sind. Einige von ihnen sind sogar sauer, wie es bei Tellursäure Te (OH) der Fall ist.6.
Das Hydroxid stellt ein Löslichkeitsgleichgewicht mit dem umgebenden Lösungsmittel her. Wenn es zum Beispiel Wasser ist, wird das Gleichgewicht wie folgt ausgedrückt:
M (OH)zwei <=> M.zwei+(ac) + OH-(ac)
Wobei (ac) bedeutet, dass das Medium wässrig ist. Wenn der Feststoff unlöslich ist, ist die gelöste OH-Konzentration gering oder vernachlässigbar. Aus diesem Grund können unlösliche Metallhydroxide keine so basischen Lösungen wie NaOH erzeugen..
Daraus lässt sich ableiten, dass Hydroxide sehr unterschiedliche Eigenschaften aufweisen, die mit der chemischen Struktur und den Wechselwirkungen zwischen Metall und OH zusammenhängen. Obwohl viele ionisch sind und unterschiedliche kristalline Strukturen aufweisen, weisen andere komplexe und ungeordnete polymere Strukturen auf..
Eigenschaften von Hydroxiden
OH-Anion-
Das Hydroxylion ist ein Sauerstoffatom, das kovalent an Wasserstoff gebunden ist. Somit kann dies leicht als OH dargestellt werden-. Die negative Ladung befindet sich auf dem Sauerstoff und macht dieses Anion zu einer Elektronendonorspezies: einer Base.
Wenn der OH- spendet seine Elektronen an einen Wasserstoff, ein H-Molekül wird gebildetzweiO. Sie können Ihre Elektronen auch an positiv geladene Spezies abgeben: wie Metallzentren M.+. Somit wird durch die Dativ-M-OH-Bindung ein Koordinationskomplex gebildet (Sauerstoff liefert das Elektronenpaar).
Dazu muss der Sauerstoff jedoch effizient mit dem Metall koordinieren können, da sonst die Wechselwirkungen zwischen M und OH einen ausgeprägten ionischen Charakter haben (M.+ Oh-). Da das Hydroxylion in allen Hydroxiden gleich ist, liegt der Unterschied zwischen allen in dem Kation, das es begleitet.
Da dieses Kation von jedem Metall im Periodensystem (Gruppen 1, 2, 13, 14, 15, 16 oder den Übergangsmetallen) stammen kann, variieren die Eigenschaften solcher Hydroxide ebenfalls enorm, obwohl alle einige Aspekte gemeinsam betrachten.
Ionischer und grundlegender Charakter
In Hydroxiden haben sie, obwohl sie Koordinationsbindungen haben, einen latenten ionischen Charakter. In einigen wie NaOH sind ihre Ionen Teil eines Kristallgitters, das aus Na-Kationen besteht+ und OH-Anionen- im Verhältnis 1: 1; das heißt, für jedes Na-Ion+ Es gibt ein OH-Ion- Gegenstück.
Abhängig von der Ladung des Metalls gibt es mehr oder weniger OH-Anionen- um es herum. Zum Beispiel für ein Metallkation M.zwei+ es wird zwei OH-Ionen geben- Interaktion mit ihm: M (OH)zwei, was als HO skizziert ist- M.zwei+ Oh-. Ebenso geschieht es mit den Metallen M.3+ und mit anderen mit positiveren Ladungen (obwohl sie selten 3+ überschreiten).
Dieser ionische Charakter ist für viele der physikalischen Eigenschaften wie Schmelz- und Siedepunkte verantwortlich. Diese sind hoch und spiegeln die elektrostatischen Kräfte wider, die innerhalb des Kristallgitters wirken. Wenn sich Hydroxide auflösen oder schmelzen, können sie aufgrund der Beweglichkeit ihrer Ionen elektrischen Strom leiten..
Nicht alle Hydroxide haben jedoch die gleichen Kristallgitter. Diejenigen mit den stabilsten lösen sich weniger wahrscheinlich in polaren Lösungsmitteln wie Wasser. In der Regel sind die Ionenradien von M umso unterschiedlicher+ und OH-, löslicher wird das gleiche sein.
Periodischer Trend
Dies erklärt, warum die Löslichkeit von Alkalimetallhydroxiden zunimmt, wenn man sich in der Gruppe nach unten bewegt. Somit ist die zunehmende Reihenfolge der Löslichkeiten in Wasser für diese wie folgt: LiOH Das OH- ist ein kleines Anion, und wenn das Kation voluminöser wird, wird das Kristallgitter energetisch schwächer. Andererseits bilden Erdalkalimetalle aufgrund ihrer höheren positiven Ladungen weniger lösliche Hydroxide. Dies liegt daran, dass die M.zwei+ zieht OH stärker an- im Vergleich zu M.+. Ebenso sind seine Kationen kleiner und daher in Bezug auf OH weniger ungleich groß-. Das Ergebnis ist ein experimenteller Beweis dafür, dass NaOH viel basischer als Ca (OH) ist.zwei. Die gleiche Überlegung kann für andere Hydroxide angewendet werden, entweder für diejenigen der Übergangsmetalle oder für diejenigen der p-Blockmetalle (Al, Pb, Te usw.).. Je kleiner und größer auch der Ionenradius und die positive Ladung von M.+, Je geringer der ionische Charakter des Hydroxids ist, desto geringer sind die mit sehr hohen Ladungsdichten. Ein Beispiel hierfür ist Berylliumhydroxid Be (OH)zwei. Er istzwei+ es ist ein sehr kleines Kation und seine zweiwertige Ladung macht es elektrisch sehr dicht. Hydroxide M (OH)zwei reagieren mit Säuren unter Bildung eines wässrigen Komplexes, dh M.+ endet mit Wassermolekülen umgeben. Es gibt jedoch eine begrenzte Anzahl von Hydroxiden, die auch mit Basen reagieren können. Dies sind sogenannte amphotere Hydroxide. Amphotere Hydroxide reagieren sowohl mit Säuren als auch mit Basen. Die zweite Situation kann durch die folgende chemische Gleichung dargestellt werden: M (OH)zwei + Oh- => M (OH)3- Aber wie kann man feststellen, ob ein Hydroxid amphoter ist? Durch ein einfaches Laborexperiment. Da viele Metallhydroxide in Wasser unlöslich sind, wird einer Lösung mit den M-Ionen eine starke Base zugesetzt+ gelöst, zum Beispiel Al3+, das entsprechende Hydroxid fällt aus: Zum3+(aq) + 3OH-(ac) => Al (OH)3(s) Aber mit einem Überschuss an OH- Das Hydroxid reagiert weiter: Al (OH)3(s) + OH- => Al (OH)4-(ac) Infolgedessen wird der neue negativ geladene Komplex durch die umgebenden Wassermoleküle solvatisiert, wodurch der weiße Aluminiumhydroxid-Feststoff aufgelöst wird. Diejenigen Hydroxide, die bei zusätzlicher Zugabe der Base unverändert bleiben, verhalten sich nicht wie Säuren und sind daher nicht amphoter. Hydroxide können kristalline Strukturen aufweisen, die denen vieler Salze oder Oxide ähnlich sind; einige einfach und andere sehr komplex. Darüber hinaus können diejenigen, bei denen der ionische Charakter abnimmt, Metallzentren aufweisen, die durch Sauerstoffbrücken (HOM-O-MOH) verbunden sind.. In Lösung sind die Strukturen unterschiedlich. Obwohl es für hochlösliche Hydroxide ausreicht, sie als in Wasser gelöste Ionen zu betrachten, ist es für andere notwendig, die Koordinationschemie zu berücksichtigen. Somit ist jedes Kation M.+ es kann auf eine begrenzte Anzahl von Arten koordiniert werden. Je sperriger es ist, desto größer ist die Anzahl der Wasser- oder OH-Moleküle.- damit verbunden. Von hier kommt das berühmte Koordinationsoktaeder vieler Metalle, die in Wasser (oder einem anderen Lösungsmittel) gelöst sind: M (OHzwei)6+n, wobei n gleich der positiven Ladung des Metalls ist. Cr (OH)3, Zum Beispiel bildet es tatsächlich ein Oktaeder. Wie? Betrachtet man die Verbindung als [Cr (OHzwei)3(OH)3], von denen drei der Wassermoleküle durch OH-Anionen ersetzt sind-. Wenn alle Moleküle durch OH ersetzt würden-, dann der Komplex mit negativer Ladung und oktaedrischer Struktur [Cr (OH)6]]3-. Die -3-Ladung ist das Ergebnis der sechs negativen Ladungen des OH-. Hydroxide können als "hydratisierte Oxide" betrachtet werden. In ihnen steht "Wasser" jedoch in direktem Kontakt mit M.+;; während in den hydratisierten Oxiden MO nHzweiOder die Wassermoleküle sind Teil einer externen Koordinationssphäre (sie befinden sich nicht in der Nähe des Metalls).. Diese Wassermoleküle können durch Erhitzen einer Hydroxidprobe extrahiert werden: M (OH)zwei + Q (Wärme) => MO + H.zweiODER MO ist das Metalloxid, das infolge der Dehydratisierung des Hydroxids gebildet wird. Ein Beispiel für diese Reaktion ist diejenige, die beobachtet wird, wenn Kupferhydroxid, Cu (OH), dehydratisiert wirdzwei:: Cu (OH)zwei (blau) + Q => CuO (schwarz) + H.zweiODER Was ist der richtige Weg, um Hydroxide zu erwähnen? Die IUPAC schlug zu diesem Zweck drei Nomenklaturen vor: die traditionelle, die Aktien- und die systematische. Es ist richtig, eines der drei zu verwenden. Für einige Hydroxide kann es jedoch bequemer oder praktischer sein, es auf die eine oder andere Weise zu erwähnen. Die traditionelle Nomenklatur besteht einfach darin, das Suffix -ico zur höchsten Wertigkeit des Metalls hinzuzufügen; und das Suffix -oso zum niedrigsten. Wenn beispielsweise das Metall M Valenzen +3 und +1 aufweist, ist das Hydroxid M (OH)3 es wird Hydroxid genannt (Metallname)ico, während MOH-Hydroxid (Metallname)Bär. Um die Wertigkeit des Metalls im Hydroxid zu bestimmen, sehen Sie sich einfach die Zahl nach dem in Klammern eingeschlossenen OH an. Somit ist M (OH)5 bedeutet, dass das Metall eine Ladung oder Wertigkeit von +5 hat. Der Hauptnachteil dieser Nomenklatur besteht jedoch darin, dass sie für Metalle mit mehr als zwei Oxidationsstufen (wie Chrom und Mangan) kompliziert sein kann. In solchen Fällen werden die Präfixe hyper- und hypo- verwendet, um die höchsten und niedrigsten Valenzen zu bezeichnen.. Wenn M also nicht nur +3 und +1 Valenzen hat, sondern auch +4 und +2, dann lauten die Namen seiner Hydroxide mit den höchsten und niedrigsten Valenzen: Hydroxid hyper(Metallname)ico, und Hydroxid Schluckauf(Metallname)Bär. Von allen Nomenklaturen ist dies die einfachste. Hier folgt dem Namen des Hydroxids einfach die Wertigkeit des Metalls, das in Klammern eingeschlossen und in römischen Ziffern geschrieben ist. Wieder für das M (OH)5, Ihre Aktiennomenklatur wäre beispielsweise: (Metallname) Hydroxid (V). (V) bezeichnet dann (+5). Schließlich ist die systematische Nomenklatur dadurch gekennzeichnet, dass auf Multiplikationspräfixe (Di-, Tri-, Tetra-, Penta-, Hexa- usw.) zurückgegriffen wird. Diese Präfixe werden verwendet, um sowohl die Anzahl der Metallatome als auch der OH-Ionen anzugeben.-. Auf diese Weise wird das M (OH)5 benannt als: (Metallname) Pentahydroxid. Im Fall von Hgzwei(OH)zwei, zum Beispiel wäre es Dimercursäuredihydroxid; eines der Hydroxide, dessen chemische Struktur auf den ersten Blick komplex ist. Einige Beispiele für Hydroxide und ihre entsprechenden Nomenklaturen sind wie folgt: -NaOH (Natriumhydroxid) -Ca (OH) 2 (Calciumhydroxid) -Fe (OH)3. (Eisenhydroxid; Eisen (III) -hydroxid; oder Eisentrihydroxid) -V (OH)5 (Pervanadenhydroxid; Vanadium (V) -hydroxid; oder Vanadiumpentahydroxid).. -Sn (OH)4 (Staninhydroxid; Zinn (IV) -hydroxid; oder Zinntetrahydroxid). -Ba (OH)zwei (Bariumhydroxid oder Bariumdihydroxid). -Mn (OH)6 (Manganhydroxid, Mangan (VI) -hydroxid oder Manganhexahydroxid). -AgOH (Silberhydroxid, Silberhydroxid oder Silberhydroxid). Beachten Sie, dass für diese Verbindung kein Unterschied zwischen der Stamm- und der systematischen Nomenklatur besteht. -Pb (OH)4 (Bleihydroxid, Blei (IV) -hydroxid oder Bleitetrahydroxid). -LiOP (Lithiumhydroxid). -Cd (OH) 2 (Cadmiumhydroxid) -Ba (OH)zwei (Bariumhydroxid) -ChromhydroxidAmphoterismus
Strukturen
Dehydratisierungsreaktion
Nomenklatur
Traditionell
Lager
Systematisch
Beispiele für Hydroxide


Verweise


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.