
Anhydrideigenschaften, wie sie gebildet werden und Anwendungen
Das Anhydride Es sind chemische Verbindungen, die aus der Vereinigung zweier Moleküle durch Freisetzung von Wasser entstehen. Somit könnte es als Dehydratisierung der Ausgangssubstanzen angesehen werden; obwohl es nicht genau wahr ist.
In der organischen und anorganischen Chemie werden sie erwähnt, und in beiden Zweigen unterscheidet sich ihr Verständnis in nennenswertem Maße. Beispielsweise werden in der anorganischen Chemie die basischen und sauren Oxide als Anhydride ihrer Hydroxide bzw. Säuren betrachtet, da die ersteren mit Wasser reagieren, um die letzteren zu bilden..
Hier kann es zu Verwechslungen zwischen den Begriffen "wasserfrei" und "Anhydrid" kommen. Im Allgemeinen bezieht sich wasserfrei auf eine Verbindung, zu der es ohne Änderung seiner chemischen Natur dehydratisiert wurde (es findet keine Reaktion statt); Bei einem Anhydrid kommt es zu einer chemischen Veränderung, die sich in der Molekülstruktur widerspiegelt.
Wenn die Hydroxide und Säuren mit ihren entsprechenden Oxiden (oder Anhydriden) verglichen werden, ist ersichtlich, dass eine Reaktion stattgefunden hat. Andererseits können einige Oxide oder Salze hydratisiert werden, Wasser verlieren und die gleichen Verbindungen bleiben; aber ohne Wasser, das heißt wasserfrei.
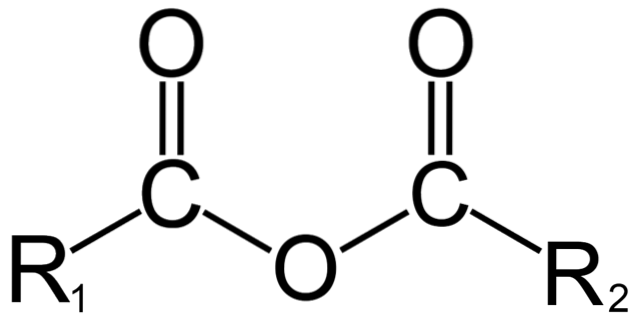
In der organischen Chemie hingegen ist unter Anhydrid die ursprüngliche Definition zu verstehen. Eines der bekanntesten Anhydride sind beispielsweise solche, die von Carbonsäuren abgeleitet sind (oberes Bild). Diese bestehen aus der Vereinigung zweier Acylgruppen (-RCO) durch ein Sauerstoffatom.
In seiner allgemeinen Struktur ist es mit R bezeichnet1 für eine Acylgruppe und R.zwei für die zweite Acylgruppe. Weil R.1 und R.zwei Sie sind unterschiedlich, sie stammen aus verschiedenen Carbonsäuren und es ist dann ein asymmetrisches Säureanhydrid. Wenn beide Substituenten R (unabhängig davon, ob sie aromatisch sind oder nicht) gleich sind, sprechen wir in diesem Fall von einem symmetrischen Säureanhydrid.
Wenn zwei Carbonsäuren unter Bildung des Anhydrids binden, kann sich Wasser sowie andere Verbindungen bilden oder nicht. Alles hängt von der Struktur dieser Säuren ab.
Artikelverzeichnis
- 1 Eigenschaften von Anhydriden
- 1.1 Chemische Reaktionen
- 2 Wie entstehen Anhydride??
- 2.1 Cyclische Anhydride
- 3 Nomenklatur
- 4 Anwendungen
- 4.1 Organische Anhydride
- 5 Beispiele
- 5.1 Bernsteinsäureanhydrid
- 5.2 Glutarsäureanhydrid
- 6 Referenzen
Eigenschaften von Anhydriden
Die Eigenschaften von Anhydriden hängen davon ab, auf welche Sie sich beziehen. Fast alle haben gemeinsam, dass sie mit Wasser reagieren. Für die sogenannten basischen Anhydride in anorganischen Stoffen sind tatsächlich einige von ihnen sogar in Wasser (MgO) unlöslich, so dass sich diese Aussage auf die Anhydride von Carbonsäuren konzentrieren wird.
Schmelz- und Siedepunkte hängen von der Molekülstruktur und den intermolekularen Wechselwirkungen des (RCO) ab.zweiOder dies ist die allgemeine chemische Formel dieser organischen Verbindungen.
Wenn die Molmasse von (RCO)zweiOder es ist niedrig, wahrscheinlich eine farblose Flüssigkeit bei Raumtemperatur und Druck. Zum Beispiel Essigsäureanhydrid (oder Ethansäureanhydrid), (CH3CO)zweiOder es ist eine Flüssigkeit und die von größter industrieller Bedeutung, da ihre Produktion sehr groß ist..
Die Reaktion zwischen Essigsäureanhydrid und Wasser wird durch die folgende chemische Gleichung dargestellt:
(CH3CO)zweiO + H.zweiO => 2CH3COOH
Beachten Sie, dass bei Zugabe des Wassermoleküls zwei Essigsäuremoleküle freigesetzt werden. Die Umkehrreaktion kann jedoch bei Essigsäure nicht auftreten:
2CH3COOH => (CH3CO)zweiO + H.zweiO (tritt nicht auf)
Es ist notwendig, auf einen anderen Syntheseweg zurückzugreifen. Dicarbonsäuren können dies dagegen durch Erhitzen tun; Dies wird jedoch im nächsten Abschnitt erläutert.
Chemische Reaktionen
Hydrolyse
Eine der einfachsten Reaktionen von Anhydriden ist ihre Hydrolyse, die gerade für Essigsäureanhydrid gezeigt wurde. Zusätzlich zu diesem Beispiel gibt es das von Schwefelsäureanhydrid:
H.zweiS.zweiODER7 + H.zweiODER <=> 2HzweiSW4
Hier haben Sie ein anorganisches Säureanhydrid. Beachten Sie, dass für die H.zweiS.zweiODER7 (auch als Schwefelsäure bezeichnet) ist die Reaktion reversibel, so dass H erhitzt wirdzweiSW4 Konzentrat führt zur Bildung seines Anhydrids. Wenn es sich andererseits um eine verdünnte Lösung von H handeltzweiSW4, SO wird freigegeben3, Schwefelsäureanhydrid.
Veresterung
Säureanhydride reagieren mit Alkoholen, dazwischen Pyridin, zu einem Ester und einer Carbonsäure. Betrachten Sie zum Beispiel die Reaktion zwischen Essigsäureanhydrid und Ethanol:
(CH3CO)zweiO + CH3CHzweiOH => CH3COzweiCHzweiCH3 + CH3COOH
So bildet sich das Esterethylethanoat CH3COzweiCHzweiCH3, und Ethansäure (Essigsäure).
In der Praxis geschieht die Substitution des Wasserstoffs der Hydroxylgruppe durch eine Acylgruppe:
R.1-OH => R.1-OCORzwei
Im Fall von (CH3CO)zweiOder seine Acylgruppe ist -COCH3. Daher soll die OH-Gruppe eine Acylierung erfahren. Acylierung und Veresterung sind jedoch keine austauschbaren Konzepte; Die Acylierung kann direkt an einem aromatischen Ring erfolgen, der als Friedel-Crafts-Acylierung bekannt ist.
So werden Alkohole in Gegenwart von Säureanhydriden durch Acylierung verestert.
Andererseits reagiert nur eine der beiden Acylgruppen mit dem Alkohol, die andere bleibt beim Wasserstoff und bildet eine Carbonsäure; das für den Fall von (CH3CO)zweiOder ist Ethansäure.
Amidation
Säureanhydride reagieren mit Ammoniak oder Aminen (primär und sekundär) unter Bildung von Amiden. Die Reaktion ist der gerade beschriebenen Veresterung sehr ähnlich, aber die ROH wird durch ein Amin ersetzt; zum Beispiel ein sekundäres Amin, R.zweiNH.
Wiederum ist die Reaktion zwischen (CH3CO)zweiO und Diethylamin, EtzweiNH:
(CH3CO)zweiO + 2EtzweiNH => CH3CONEtzwei + CH3GURREN- +NHzweiEtzwei
Und Diethylacetamid, CH3CONEtzwei, und ein carboxyliertes Salz von Ammonium, CH3GURREN- +NHzweiEtzwei.
Obwohl die Gleichung etwas schwer zu verstehen scheint, schauen Sie sich nur an, wie die -COCH-Gruppe aussieht3 Ersetzen Sie das H eines EtzweiNH zur Bildung des Amids:
EtzweiNH => EtzweiNCOCH3
Anstelle einer Amidierung ist die Reaktion immer noch eine Acylierung. Alles ist in diesem Wort zusammengefasst; Dieses Mal unterliegt das Amin einer Acylierung und nicht dem Alkohol.
Wie entstehen Anhydride??
Anorganische Anhydride entstehen durch Umsetzung des Elements mit Sauerstoff. Wenn das Element metallisch ist, wird somit ein Metalloxid oder basisches Anhydrid gebildet; und wenn es nichtmetallisch ist, wird ein nichtmetallisches Oxid oder Säureanhydrid gebildet.
Bei organischen Anhydriden ist die Reaktion unterschiedlich. Zwei Carbonsäuren können sich nicht direkt verbinden, um Wasser freizusetzen und Säureanhydrid zu bilden. Die Beteiligung einer noch nicht erwähnten Verbindung ist notwendig: Acylchlorid, RCOCl.
Die Carbonsäure reagiert mit dem Acylchlorid unter Bildung des jeweiligen Anhydrids und Chlorwasserstoffs:
R.1COCl + R.zweiCOOH => (R.1CO) ODER (CORzwei) + HCl
CH3COCl + CH3COOH => (CH3CO)zweiO + HCl
Ein CH3 kommt aus der Acetylgruppe CH3CO- und das andere ist bereits in Essigsäure vorhanden. Die Wahl eines bestimmten Acylchlorids sowie der Carbonsäure kann zur Synthese eines symmetrischen oder asymmetrischen Säureanhydrids führen.
Cyclische Anhydride
Im Gegensatz zu den anderen Carbonsäuren, die ein Acylchlorid benötigen, können Dicarbonsäuren zu ihrem entsprechenden Anhydrid kondensieren. Dazu ist es notwendig, sie zu erhitzen, um die Freisetzung von H zu fördernzweiO. Zum Beispiel wird die Bildung von Phthalsäureanhydrid aus Phthalsäure gezeigt.

Beachten Sie, wie der fünfeckige Ring fertiggestellt ist und der Sauerstoff, der beide C = O-Gruppen verbindet, ein Teil davon ist. Dies ist ein cyclisches Anhydrid. Ebenso kann erkannt werden, dass Phthalsäureanhydrid ein symmetrisches Anhydrid ist, da beide R.1 als R.zwei sind identisch: ein aromatischer Ring.
Nicht alle Dicarbonsäuren sind in der Lage, ihr Anhydrid zu bilden, da sie gezwungen sind, immer größere Ringe zu vervollständigen, wenn ihre COOH-Gruppen weit voneinander entfernt sind. Der größte Ring, der gebildet werden kann, ist ein hexagonaler Ring, der größer ist als der, dass die Reaktion nicht stattfindet.
Nomenklatur
Wie heißen Anhydride? Abgesehen von den anorganischen, die für Oxidprobleme relevant sind, hängen die Namen der bisher erläuterten organischen Anhydride von der Identität von R ab1 und R.zwei;; das heißt, von seinen Acylgruppen.
Wenn die beiden Rs gleich sind, ersetzen Sie einfach das Wort "Säure" durch "Anhydrid" im jeweiligen Namen der Carbonsäure. Und wenn im Gegenteil die beiden Rs unterschiedlich sind, werden sie in alphabetischer Reihenfolge benannt. Um zu wissen, wie man es nennt, müssen Sie zuerst sehen, ob es sich um ein symmetrisches oder asymmetrisches Säureanhydrid handelt.
Das CH3CO)zweiO ist symmetrisch, da R.1= R.zwei = CH3. Es leitet sich von Essigsäure oder Ethansäure ab, daher lautet sein Name nach der vorherigen Erklärung: Essigsäure oder Ethansäureanhydrid. Gleiches gilt für das gerade erwähnte Phthalsäureanhydrid.
Angenommen, wir haben das folgende Anhydrid:
CH3CO (O) COCHzweiCHzweiCHzweiCHzweiCHzweiCH3
Die Acetylgruppe links stammt von Essigsäure und die rechts von Heptansäure. Um dieses Anhydrid zu benennen, müssen Sie seine R-Gruppen in alphabetischer Reihenfolge benennen. Der Name lautet also: Heptansäuresäureanhydrid.
Anwendungen
Anorganische Anhydride haben endlose Anwendungen, von der Synthese und Formulierung von Materialien, Keramiken, Katalysatoren, Zementen, Elektroden, Düngemitteln usw. bis hin zur Beschichtung der Erdkruste mit ihren Tausenden von Eisen- und Aluminiummineralien und dem von ausgeatmeten Kohlendioxid lebende Organismen.
Sie stellen die Ausgangsquelle dar, den Punkt, an dem viele in anorganischen Synthesen verwendete Verbindungen abgeleitet werden. Eines der wichtigsten Anhydride ist Kohlendioxid, COzwei. Es ist zusammen mit Wasser für die Photosynthese essentiell. Und auf industrieller Ebene ist die SO3 Es ist wesentlich, da daraus die beklagte Schwefelsäure erhalten wird.
Vielleicht ist das Anhydrid mit den meisten Anwendungen und für das Vorhandensein (solange es Leben gibt) eines aus Phosphorsäure: Adenosintriphosphat, besser bekannt als ATP, das in der DNA und der "Energiewährung" des Stoffwechsels vorhanden ist..
Organische Anhydride
Säureanhydride reagieren durch Acylierung entweder zu einem Alkohol und bilden einen Ester, ein Amin, wodurch ein Amid oder ein aromatischer Ring entsteht.
Es gibt Millionen von jeder dieser Verbindungen und Hunderttausende von Carbonsäureoptionen, um ein Anhydrid herzustellen; Daher wachsen die Synthesemöglichkeiten dramatisch.
Daher besteht eine der Hauptanwendungen darin, eine Acylgruppe in eine Verbindung einzubauen und eines der Atome oder Gruppen ihrer Struktur zu substituieren..
Jedes einzelne Anhydrid hat seine eigenen Anwendungen, aber im Allgemeinen reagieren alle auf ähnliche Weise. Aus diesem Grund werden diese Arten von Verbindungen verwendet, um Polymerstrukturen zu modifizieren und neue Polymere zu erzeugen; d.h. Copolymere, Harze, Beschichtungen usw..
Zum Beispiel wird Essigsäureanhydrid verwendet, um alle OH-Gruppen in Cellulose zu acetylieren (unteres Bild). Damit wird jedes H des OH durch eine Acetylgruppe, COCH, ersetzt3.
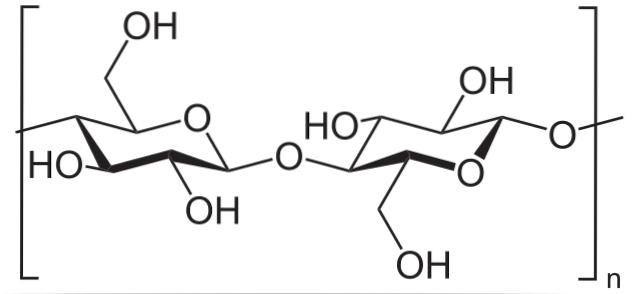
Auf diese Weise wird das Celluloseacetatpolymer erhalten. Die gleiche Reaktion kann mit anderen Polymerstrukturen mit NH-Gruppen beschrieben werdenzwei, auch anfällig für Acylierung.
Diese Acylierungsreaktionen eignen sich auch zur Synthese von Arzneimitteln wie Aspirin (Säure) AcetylSalicylsäure).
Beispiele
Es wird gezeigt, dass einige andere Beispiele für organische Anhydride fertig sind. Obwohl sie nicht erwähnt werden, können Sauerstoffatome anstelle von Schwefel eingesetzt werden, wodurch Schwefel oder sogar Phosphoranhydride erhalten werden..
-C.6H.5CO (O) COC6H.5: Benzoesäureanhydrid. Gruppe C.6H.5 repräsentiert einen Benzolring. Bei seiner Hydrolyse entstehen zwei Benzoesäuren.
-HCO (O) COH: Ameisensäureanhydrid. Bei seiner Hydrolyse entstehen zwei Ameisensäuren.
- C.6H.5CO (O) COCHzweiCH3: Benzoesäure-Propansäureanhydrid. Bei seiner Hydrolyse entstehen Benzoesäure und Propansäure.
-C.6H.elfCO (O) COC6H.elf: Cyclohexancarbonsäureanhydrid. Im Gegensatz zu aromatischen Ringen sind diese ohne Doppelbindungen gesättigt.
-CH3CHzweiCHzweiCO (O) COCHzweiCH3: Propansäurebutansäureanhydrid.
Bernsteinsäureanhydrid

Hier haben Sie einen anderen Cyclus, der von Bernsteinsäure abgeleitet ist, eine Dicarbonsäure. Beachten Sie, wie die drei Sauerstoffatome die chemische Natur dieser Art von Verbindung offenbaren.
Maleinsäureanhydrid ist Bernsteinsäureanhydrid sehr ähnlich, mit dem Unterschied, dass zwischen den Kohlenstoffen, die die Basis des Fünfecks bilden, eine Doppelbindung besteht..
Glutarsäureanhydrid
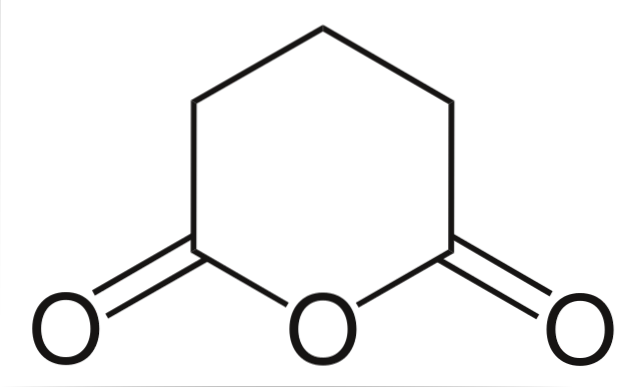
Und schließlich wird Glutarsäureanhydrid gezeigt. Diese unterscheidet sich strukturell von allen anderen dadurch, dass sie aus einem sechseckigen Ring besteht. Auch hier fallen die drei Sauerstoffatome in der Struktur auf.
Andere komplexere Anhydride können immer durch die drei Sauerstoffatome nachgewiesen werden, die sehr nahe beieinander liegen.
Verweise
- Die Herausgeber der Encyclopaedia Britannica. (2019). Anhydrid. Enclyclopaedia Britannica. Wiederhergestellt von: britannica.com
- Helmenstine, Anne Marie, Ph.D. (08. Januar 2019). Säureanhydrid Definition in der Chemie. Wiederhergestellt von :oughtco.com
- Chemie LibreTexts. (s.f.). Anhydride. Wiederhergestellt von: chem.libretexts.org
- Graham Solomons T. W., Craig B. Fryhle. (2011). Organische Chemie. Amine. (10th Auflage.). Wiley plus.
- Carey F. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). CENGAGE Lernen.
- Morrison und Boyd. (1987). Organische Chemie. (Fünfte Ausgabe). Addison-Wesley Iberoamericana.
- Wikipedia. (2019). Organisches Säureanhydrid. Wiederhergestellt von: en.wikipedia.org


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.