
Struktur, Eigenschaften, Herstellung, Verwendung von Calciumhydroxid (Ca (OH) 2)

Das Kalziumhydroxid ist eine anorganische Verbindung mit der chemischen Formel Ca (OH)zwei. Es ist ein weißes Pulver, das seit Tausenden von Jahren verwendet wird. In dieser Zeit hat es mehrere traditionelle Namen oder Spitznamen erhalten. Unter ihnen können wir gelöschten, toten, chemischen, hydratisierten oder feinen Kalk erwähnen.
In der Natur ist es in einem seltenen Mineral namens Portlandit der gleichen Farbe erhältlich. Aus diesem Grund Ca (OH)zwei Es wird nicht direkt aus diesem Mineral gewonnen, sondern aus einer Wärmebehandlung, gefolgt von einer Hydratation des Kalksteins. Daraus wird Kalk, CaO, erhalten, der später gequencht oder hydratisiert wird, um Ca (OH) zu erzeugen.zwei.

Ca (OH)zwei es ist eine relativ schwache Base in Wasser, da es sich in heißem Wasser kaum auflösen kann; aber seine Löslichkeit nimmt in kaltem Wasser zu, weil seine Hydratation exotherm ist. Seine Basizität ist jedoch weiterhin ein Grund, bei der Handhabung vorsichtig damit umzugehen, da es zu Verbrennungen an jedem Körperteil kommen kann..
Es wurde als pH-Regler für verschiedene Materialien oder Lebensmittel verwendet und ist eine gute Quelle für Kalzium in Bezug auf seine Masse. Es findet Anwendung in der Papierindustrie, bei der Desinfektion von Abwasser, bei Enthaarungsprodukten und bei Lebensmitteln aus Maismehl.
Die wichtigste Verwendung war jedoch das Baumaterial, da Kalk beim Mischen mit den anderen Bestandteilen in Gips oder Mörtel hydratisiert. In diesen gehärteten Gemischen ist Ca (OH)zwei absorbiert Kohlendioxid aus der Luft, um Sandkristalle zusammen mit denen aus Calciumcarbonat zu verfestigen.
Derzeit wird noch geforscht, um bessere Baumaterialien mit Ca (OH) zu entwickeln.zwei direkt in seiner Zusammensetzung als Nanopartikel.
Artikelverzeichnis
- 1 Struktur
- 1.1 Kristall und seine Ionen
- 1.2 Morphologie
- 2 Eigenschaften
- 2.1 Aussehen
- 2,2 Molmasse
- 2.3 Schmelzpunkt
- 2.4 Dichte
- 2,5 pH
- 2.6 Löslichkeit in Wasser
- 2,7 Kps
- 2.8 Brechungsindex
- 2.9 Stabilität
- 3 Erhalten
- 4 Verwendungen
- 4.1 Lebensmittelbehandlung
- 4.2 Abwasserdesinfektionsmittel
- 4.3 Papierindustrie
- 4.4 Gasabsorber
- 4.5 Körperpflege
- 4.6 Bauarbeiten
- 5 Risiken und Nebenwirkungen
- 6 Referenzen
Struktur
Kristall und seine Ionen
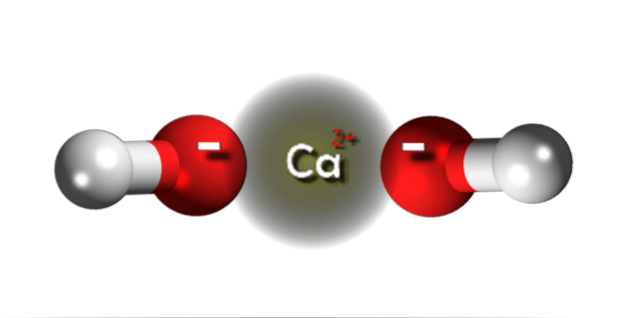
Im oberen Bild haben wir die Ionen, aus denen Calciumhydroxid besteht. Die gleiche Formel Ca (OH)zwei weist darauf hin, dass für jedes Kation Ca.zwei+ Es gibt zwei OH-Anionen- die durch elektrostatische Anziehung mit ihm interagieren. Das Ergebnis ist, dass beide Ionen einen Kristall mit einer hexagonalen Struktur bilden.
In solchen hexagonalen Kristallen von Ca (OH)zwei die Ionen sind sehr nahe beieinander, was den Anschein einer Polymerstruktur erweckt; obwohl es aufgrund des bemerkenswerten Unterschieds in der Elektronegativität zwischen den beiden Elementen formal keine kovalente Ca-O-Bindung gibt.
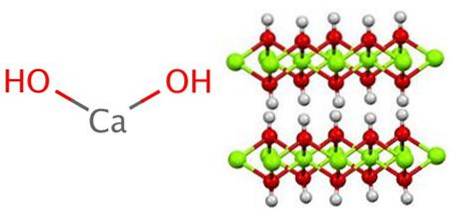
Die Struktur erzeugt Oktaeder CaO6, das heißt, die Ca.zwei+ interagiert mit sechs OH- (ACzwei+-Oh-).
Eine Reihe dieser Oktaeder bildet eine Schicht des Kristalls, die über Wasserstoffbrückenbindungen, die sie intermolekular kohäsiv halten, mit anderen interagieren kann. Diese Wechselwirkung verschwindet jedoch bei einer Temperatur von 580 ºC, wenn Ca (OH) dehydratisiert wirdzwei zu CaO.
Auf der Seite der hohen Drücke gibt es diesbezüglich nicht viele Informationen, obwohl Studien gezeigt haben, dass der hexagonale Kristall bei einem Druck von 6 GPa einen Übergang von der hexagonalen zur monoklinen Phase durchläuft; und damit die Verformung der Oktaeder CaO6 und seine Schichten.
Morphologie
Die Kristalle von Ca (OH)zwei Sie sind sechseckig, aber das ist kein Hindernis für sie, irgendeine Morphologie anzunehmen. Einige dieser Strukturen (wie Stränge, Flocken oder Steine) sind poröser als andere, robust oder flach, was sich direkt auf ihre endgültige Anwendung auswirkt..
Daher ist es nicht dasselbe, Kristalle aus dem Mineral Portlandit zu verwenden, als sie so zu synthetisieren, dass sie aus Nanopartikeln bestehen, bei denen einige strenge Parameter eingehalten werden. wie der Hydratationsgrad, die verwendete CaO-Konzentration und die Zeit, in der der Kristall wachsen kann.
Eigenschaften
Aussehen
Weißer, geruchloser, pudriger Feststoff mit bitterem Geschmack.
Molmasse
74,093 g / mol
Schmelzpunkt
580 ° C. Bei dieser Temperatur zersetzt es sich und setzt Wasser frei, so dass es niemals verdampft:
Ca (OH)zwei => CaO + H.zweiODER
Dichte
2,211 g / cm3
pH
Eine gesättigte wässrige Lösung derselben hat einen pH-Wert von 12,4 bei 25 ° C..
Wasserlöslichkeit
Die Löslichkeit von Ca (OH)zwei im Wasser nimmt sie mit steigender Temperatur ab. Beispielsweise beträgt seine Löslichkeit bei 0 ° C 1,89 g / l; bei 20 ºC und 100 ºC sind dies 1,73 g / l bzw. 0,66 g / l.
Dies weist auf eine thermodynamische Tatsache hin: die Hydratation von Ca (OH)zwei ist exotherm, also würde die Gleichung laut Le Chateliers Prinzip lauten:
Ca (OH)zwei <=> ACzwei+ + 2OH- + Q.
Wobei Q die freigesetzte Wärme ist. Je heißer das Wasser, desto mehr Gleichgewicht wird nach links tendieren; das heißt, weniger Ca (OH) löst sich aufzwei. Aus diesem Grund löst es sich in kaltem Wasser viel stärker auf als in kochendem Wasser..
Andererseits nimmt die Löslichkeit zu, wenn der pH aufgrund der Neutralisation der OH-Ionen sauer wird.- und die Verschiebung des vorderen Gleichgewichts nach rechts. Dabei wird noch mehr Wärme freigesetzt als in neutralem Wasser. Neben sauren wässrigen Lösungen kann Ca (OH)zwei es ist auch in Glycerin löslich.
K.ps
5.5 10-6. Dieser Wert wird als klein angesehen und stimmt mit der geringen Löslichkeit von Ca (OH) überein.zwei im Wasser (gleiche Balance wie oben).
Brechungsindex
1,574
Stabilität
Ca (OH)zwei bleibt stabil, solange es nicht CO ausgesetzt istzwei aus der Luft, wie es absorbiert und Calciumcarbonat, CaCO bildet3. Daher beginnt es, sich zu einer festen Mischung von Ca (OH) -Kristallen zu verunreinigenzwei-Dieb3, wo es CO-Anionen gibt3zwei- im Wettbewerb mit dem OH- mit Ca interagierenzwei+::
Ca (OH)zwei + COzwei => CaCO3 + H.zweiODER
In der Tat ist dies der Grund, warum konzentrierte Lösungen von Ca (OH)zwei Sie werden milchig, wenn eine Suspension von CaCO-Partikeln auftritt3.
Erhalten
Ca (OH)zwei Es wird kommerziell durch Umsetzen von Kalk, CaO, mit einem zwei- bis dreifachen Überschuss an Wasser erhalten:
CaO + H.zweiO => Ca (OH)zwei
Dabei kann jedoch eine Carbonisierung von Ca (OH) auftretenzwei, genau wie oben erklärt.
Andere Verfahren, um es zu erhalten, sind lösliche Calciumsalze wie CaClzwei oder Ca (NO3)zwei, und basisiere sie mit NaOH, so dass Ca (OH) ausfälltzwei. Durch Steuern von Parametern wie Wasservolumen, Temperatur, pH-Wert, Lösungsmittel, Karbonisierungsgrad, Reifungszeit usw. können Nanopartikel mit unterschiedlichen Morphologien synthetisiert werden.
Es kann auch hergestellt werden, indem natürliche und nachwachsende Rohstoffe oder Abfälle aus einer Industrie ausgewählt werden, die reich an Kalzium sind. Wenn sie erhitzt und verarbeitet werden, besteht ihre Asche aus Kalk. und von hier aus kann wieder das Ca (OH) hergestellt werdenzwei durch Hydratisierung dieser Asche, ohne dass Kalkstein, CaCO, verschwendet werden muss3.
Zu diesem Zweck wurde beispielsweise Agaventasche verwendet, um Abfällen aus der Tequila-Industrie einen Mehrwert zu verleihen..
Anwendungen
Lebensmittelverarbeitung

Calciumhydroxid ist in einigen Lebensmitteln in einigen seiner Zubereitungsstufen enthalten. Zum Beispiel werden Gurken wie Essiggurken in eine wässrige Lösung getaucht, um sie knuspriger zu machen, wenn sie in Essig verpackt werden. Dies liegt daran, dass die Proteine auf seiner Oberfläche Kalzium aus dem Medium absorbieren..
Das gleiche gilt für Maiskörner, bevor sie in Mehl umgewandelt werden, da es hilft, Vitamin B freizusetzen3 (Niacin) und macht es leicht zu mahlen. Das darin enthaltene Kalzium wird auch verwendet, um bestimmten Säften einen Nährwert zu verleihen.
Ca (OH)zwei Es kann auch Backpulver in einigen Brotrezepten ersetzen und die aus Zuckerrohr und Rüben gewonnenen zuckerhaltigen Lösungen klären..
Abwasserdesinfektionsmittel
Die klärende Wirkung von Ca (OH)zwei Es ist, weil es als Flockungsmittel wirkt; das heißt, es erhöht die Größe der suspendierten Partikel, bis sie Flocken bilden, die sich später absetzen oder filtriert werden können.
Diese Eigenschaft wurde verwendet, um Abwasser zu desinfizieren und seine Kolloide zu destabilisieren, die für den Anblick (und Geruch) der Zuschauer unangenehm sind..
Papierindustrie
Ca (OH)zwei Es wird im Kraft-Verfahren verwendet, um das zur Holzbehandlung verwendete NaOH zu regenerieren.
Gasabsorber
Ca (OH)zwei verwendet, um CO zu entfernenzwei von geschlossenen Räumen oder in Umgebungen, in denen ihre Anwesenheit kontraproduktiv ist.
Körperpflege
In Formulierungen für Enthaarungscremes Ca (OH)zwei Es wird stillschweigend gefunden, da seine Basizität bei der Schwächung des Keratins der Haare hilft und es daher einfacher ist, sie zu entfernen.
Konstruktion

Ca (OH)zwei Es ist seit jeher präsent und integriert die Gips- und Mörtelmassen, die beim Bau ägyptischer Architekturarbeiten wie der Pyramiden verwendet werden. auch Gebäude, Mausoleen, Wände, Treppen, Böden, Stützen und sogar zum Wiederaufbau von Zahnzement.
Seine verstärkende Wirkung beruht auf der Tatsache, dass beim "Atmen" der COzwei, die resultierenden Kristalle von CaCO3 Beenden Sie die Integration der Sande und der anderen Komponenten solcher Gemische in einem besseren Maße.
Risiken und Nebenwirkungen
Ca (OH)zwei Es ist kein stark basischer Feststoff im Vergleich zu anderen Hydroxiden, obwohl es mehr als Mg (OH) ist.zwei. Obwohl es nicht reaktiv oder brennbar ist, ist seine Basizität dennoch aggressiv genug, um leichte Verbrennungen zu verursachen..
Daher muss mit Respekt umgegangen werden, da es Augen, Zunge und Lunge reizen und andere Krankheiten auslösen kann, wie z. B. Sehverlust, starke Alkalisierung des Blutes, Hautausschläge, Erbrechen und Halsschmerzen.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2019). Kalziumhydroxid. Wiederhergestellt von: en.wikipedia.org
- Chávez Guerrero et al. (2016). Synthese und Charakterisierung von Calciumhydroxid aus Agaventasche und Untersuchung seiner antibakteriellen Aktivität. Wiederhergestellt von: scielo.org.mx
- Riko Iizuka, Takehiko Yagi, Kazuki Komatsu, Hirotada Gotou, Taku Tsuchiya, Keiji Kusaba, Hiroyuki Kagi. (2013). Kristallstruktur der Hochdruckphase von Calciumhydroxid, Portlandit: In-situ-Pulver- und Einkristall-Röntgenbeugungsstudie. Amerikanischer Mineralogist; 98 (8-9): 1421-1428. doi: doi.org/10.2138/am.2013.4386
- Hans Lohninger. (05. Juni 2019). Kalziumhydroxid. Chemie LibreTexts. Wiederhergestellt von: chem.libretexts.org
- Aniruddha S. et al. (2015). Synthese von Nano-Calciumhydroxid in wässrigem Medium. Die amerikanische Keramikgesellschaft. doi.org/10.1111/jace.14023
- Carly Vandergriendt. (12. April 2018). Wie wird Calciumhydroxid in Lebensmitteln verwendet und ist es sicher? Wiederhergestellt von: healthline.com
- Brian Clegg. (26. Mai 2015). Kalziumhydroxid. Wiederhergestellt von: chemistryworld.com



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.