
Eigenschaften, Risiken und Verwendungen von Bariumhydroxid (Ba (OH) 2)
Das Bariumhydroxid ist eine chemische Verbindung mit der Formel Ba (OH)zwei(H.zweiODER)x. Es ist eine starke Base und kann in wasserfreier, Monohydrat- oder Octohydratform vorliegen. Die Monohydratform, auch Barytwasser genannt, ist die häufigste und kommerziell verwendete. Die Struktur der wasserfreien und Monohydratverbindungen ist in Abbildung 1 dargestellt.
Bariumhydroxid kann durch Auflösen von Bariumoxid (BaO) in Wasser hergestellt werden: BaO + 9HzweiO → Ba (OH)zwei8HzweiO. Es kristallisiert als Octahydrat, das beim Erhitzen an der Luft zum Monohydrat wird. Bei 100 ° C unter Vakuum erzeugt das Monohydrat BaO und Wasser.
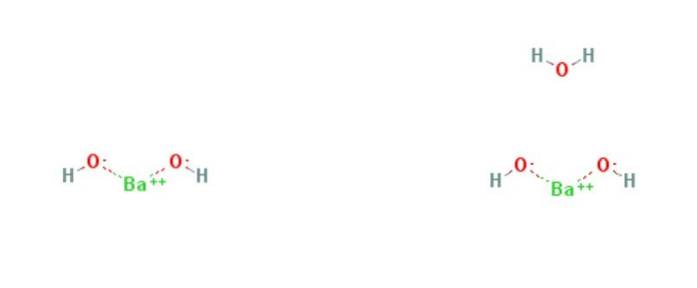
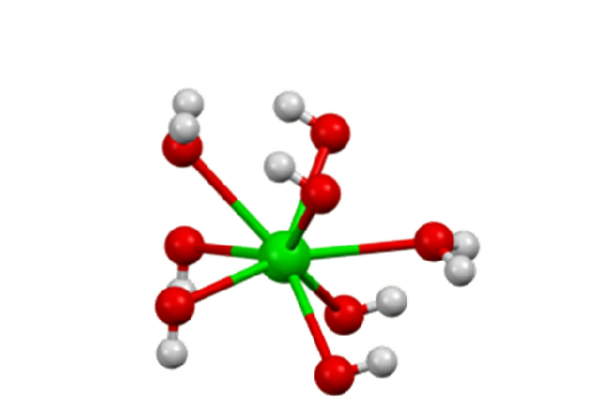
Das Monohydrat nimmt eine Schichtstruktur an (Abbildung 2). Die Ba-Zentrenzwei+ Sie nehmen eine oktaedrische Geometrie an. Jedes Zentrum Bazwei+ wird durch zwei Wasserliganden und sechs Hydroxidliganden gebunden, die jeweils doppelt und dreifach an die Ba-Zentren verbrückt sindzwei+ Nachbarn.
Im Oktahydrat zentriert sich das Bazwei+ Individuen sind wieder acht Koordinaten, teilen jedoch keine Liganden (Bariumhydroxid, S.F.).
Artikelverzeichnis
- 1 Eigenschaften von Bariumhydroxid
- 2 Reaktivität und Gefahren
- 2.1 Augenkontakt
- 2.2 Hautkontakt
- 2.3 Einatmen
- 2.4 Verschlucken
- 3 Verwendungen
- 3.1 1- Industrie
- 3.2 2- Labor
- 3.3 3- Katalysator in der Wittig-Horner-Reaktion
- 3.4 4- Andere Verwendungen
- 4 Referenzen
Bariumhydroxideigenschaften
Bariumhydroxid sind weiße oder transparente oktaedrische Kristalle. Geruchlos und mit ätzendem Geschmack (Nationales Zentrum für Biotechnologie-Informationen., 2017). Sein Aussehen ist in 3 gezeigt (IndiaMART InterMESH Ltd., S.F.).

Die wasserfreie Form hat ein Molekulargewicht von 171,34 g / mol, eine Dichte von 2,18 g / ml, einen Schmelzpunkt von 407 ° C und einen Siedepunkt von 780 ° C (Royal Society of Chemistry, 2015)..
Die Monohydratform hat ein Molekulargewicht von 189,355 g / mol, eine Dichte von 3,743 g / ml und einen Schmelzpunkt von 300 ° C (Royal Society of Chemistry, 2015)..
Die Octohydratform hat ein Molekulargewicht von 315,46 g / mol, eine Dichte von 2,18 g / ml und einen Schmelzpunkt von 78 ° C (Royal Society of Chemistry, 2015)..
Die Verbindung ist in Wasser schwer löslich und in Aceton unlöslich. Es ist eine starke Base mit einem pKa von 0,15 und 0,64 für das erste und zweite OH- beziehungsweise.
Bariumhydroxid reagiert ähnlich wie Natriumhydroxid (NaOH), ist jedoch in Wasser weniger löslich. Neutralisiert Säuren exotherm unter Bildung von Salzen plus Wasser. Kann mit Aluminium und Zink unter Bildung von Metalloxiden oder -hydroxiden reagieren und Wasserstoffgas erzeugen.
Kann Polymerisationsreaktionen in polymerisierbaren organischen Verbindungen, insbesondere Epoxiden, auslösen.
Es kann brennbare und / oder giftige Gase mit Ammoniumsalzen, Nitriden, halogenierten organischen Verbindungen, verschiedenen Metallen, Peroxiden und Hydroperoxiden erzeugen. Mischungen mit chloriertem Gummi explodieren beim Erhitzen oder Zerkleinern (BARIUMHYDROXIDE MONOHYDRATE, 2016).
Bariumhydroxid zersetzt sich beim Erhitzen auf 800 ° C zu Bariumoxid. Bei der Reaktion mit Kohlendioxid entsteht Bariumcarbonat. Seine stark alkalische wässrige Lösung unterliegt Neutralisationsreaktionen mit Säuren. Somit bildet es mit Schwefelsäure bzw. Phosphorsäure Bariumsulfat und Bariumphosphat..
H.zweiSW4 + Ba (OH)zwei Baso4 + 2HzweiODER
Die Reaktion mit Schwefelwasserstoff erzeugt Bariumsulfid. Die Ausfällung vieler unlöslicher oder weniger löslicher Bariumsalze kann aus einer doppelten Ersatzreaktion resultieren, wenn eine wässrige Lösung von Bariumhydroxid mit vielen Lösungen anderer Metallsalze gemischt wird..
Das Mischen des festen hydratisierten Bariumhydroxids mit festem Ammoniumchlorid in einem Becherglas erzeugt eine endotherme Reaktion unter Bildung einer Flüssigkeit unter Entwicklung von Ammoniak. Die Temperatur sinkt drastisch auf ca. -20 ° C (Royal Society of Chemistry, 2017).
Ba (OH)zwei (s) + 2NH4Cl (s) → BaClzwei (aq) + 2NH3 (g) + H.zweiODER

Ba (OH) 2 reagiert mit Kohlendioxid unter Bildung von Bariumcarbonat. Dies wird durch die folgende chemische Reaktion ausgedrückt:
Ba (OH) 2 + CO2 → BaCO3 + H2O.
Reaktivität und Gefahren
Bariumhydroxid wird als stabile, nicht brennbare Verbindung eingestuft, die schnell und exotherm mit Säuren reagiert und mit Kohlendioxid und Feuchtigkeit nicht kompatibel ist. Die Verbindung ist giftig und als starke Base ätzend.
Einatmen, Verschlucken oder Hautkontakt mit Material kann zu schweren oder tödlichen Verletzungen führen. Kontakt mit der geschmolzenen Substanz kann schwere Verbrennungen an Haut und Augen verursachen..
Hautkontakt sollte vermieden werden. Die Auswirkungen von Kontakt oder Einatmen können sich verzögern. Feuer kann reizende, ätzende und / oder giftige Gase erzeugen. Brandschutzabwasser kann ätzend und / oder giftig sein und Verunreinigungen verursachen.
Blickkontakt
Wenn die Verbindung mit den Augen in Kontakt kommt, sollten die Kontaktlinsen überprüft und entfernt werden. Die Augen sollten sofort mindestens 15 Minuten lang mit viel Wasser und kaltem Wasser gespült werden.
Hautkontakt
Bei Hautkontakt sollte der betroffene Bereich sofort mindestens 15 Minuten lang mit viel Wasser oder einer schwachen Säure, z. B. Essig, gespült werden, während kontaminierte Kleidung und Schuhe entfernt werden. Bedecken Sie gereizte Haut mit einem Weichmacher.
Waschen Sie Kleidung und Schuhe vor der Wiederverwendung. Bei starkem Kontakt mit einer Desinfektionsseife waschen und die kontaminierte Haut mit einer antibakteriellen Creme abdecken..
Inhalation
Bei Inhalation sollte das Opfer an einen kühlen Ort gebracht werden. Wenn nicht geatmet wird, wird künstlich beatmet. Wenn das Atmen schwierig ist, geben Sie Sauerstoff.
Verschlucken
Wenn die Verbindung verschluckt wird, sollte kein Erbrechen ausgelöst werden. Lösen Sie enge Kleidung wie Hemdkragen, Gürtel oder Krawatte.
In allen Fällen sollte sofort ein Arzt aufgesucht werden (Sicherheitsdatenblatt Bariumhydroxidmonohydrat, 2013)..
Anwendungen
1- Industrie
Industriell wird Bariumhydroxid als Vorstufe für andere Bariumverbindungen verwendet. Monohydrat wird verwendet, um Sulfat aus verschiedenen Produkten zu dehydrieren und zu entfernen. Diese Anwendung nutzt die sehr geringe Löslichkeit von Bariumsulfat aus. Diese industrielle Anwendung gilt auch für Laboranwendungen.
Bariumhydroxid wird als Additiv in Thermoplasten (wie Phenolharzen), Kratzern und PVC-Stabilisatoren verwendet, um die plastischen Eigenschaften zu verbessern. Dieses Material wird als Allzweckadditiv für Schmiermittel und Fette verwendet..
Andere industrielle Anwendungen von Bariumhydroxid umfassen die Zuckerherstellung, die Herstellung von Seifen, die Verseifung von Fett, das Schmelzen von Silikaten und die chemische Synthese anderer Bariumverbindungen und organischer Verbindungen (BARIUMHYDROXIDE, S.F.).
2- Labor
Bariumhydroxid wird in der analytischen Chemie zur Titration schwacher Säuren, insbesondere organischer Säuren, verwendet. Die klare wässrige Lösung ist im Gegensatz zu Natriumhydroxid und Kaliumhydroxid garantiert karbonatfrei, da Bariumcarbonat in Wasser unlöslich ist.
Dies ermöglicht die Verwendung von Indikatoren wie Phenolphthalein oder Thymolphthalein (mit alkalischen Farbänderungen) ohne das Risiko von Titrationsfehlern, die durch das Vorhandensein von Carbonationen verursacht werden, die viel weniger basisch sind (Mendham, Denney, Barnes & Thomas, 2000)..
Bariumhydroxid wird gelegentlich in der organischen Synthese als starke Base verwendet, beispielsweise zur Hydrolyse von Estern und Nitrilen:
Bariumhydroxid wird auch bei der Decarboxylierung von Aminosäuren verwendet, die dabei Bariumcarbonat freisetzen..
Es wird auch zur Herstellung von Cyclopentanon, Diacetonalkohol und Gamma-Lacton D-Gulonic verwendet.
3- Katalysator in der Wittig-Horner-Reaktion
Die Wittig-Horner-Reaktion, auch bekannt als Horner-Wadsworth-Emmons-Reaktion (oder HWE-Reaktion), ist eine chemische Reaktion, die in der organischen Chemie zur Stabilisierung von Phosphonatcarbanionen mit Aldehyden (oder Ketonen) verwendet wird, um überwiegend E-Alkene (trans) zu erzeugen..
Die sonkochemische Wittig-Horner-Reaktion wird durch aktiviertes Bariumhydroxid katalysiert und unter Fest-Flüssig-Grenzflächenbedingungen durchgeführt..
Der sonkochemische Prozess findet bei Raumtemperatur und mit einem geringeren Katalysatorgewicht und einer geringeren Reaktionszeit als der thermische Prozess statt. Unter diesen Bedingungen werden Ausbeuten erhalten, die denen des thermischen Prozesses ähnlich sind..
In der Arbeit von (J. V. Sinisterra, 1987) wird der Einfluss auf die Leistung der Beschallungszeit, das Gewicht des Katalysators und des Lösungsmittels analysiert. Für die Reaktion müssen kleine Mengen Wasser zugesetzt werden.
Die Art des aktiven Zentrums des im Prozess wirkenden Katalysators wird analysiert. Für den sonochemischen Prozess wird ein ETC-Mechanismus vorgeschlagen.
4- Andere Verwendungen
Bariumhydroxid hat andere Verwendungszwecke. Es wird für eine Reihe von Zwecken verwendet, z.
- Die Herstellung von Alkali.
- Glaskonstruktion.
- Vulkanisation von synthetischem Kautschuk.
- Korrosionsinhibitoren.
- Wie Bohrflüssigkeiten, Pestizide und Schmiermittel.
- Für das Kesselmittel.
- Zur Verfeinerung von pflanzlichen und tierischen Ölen.
- Für die Freskenmalerei.
- In Wasser erweichen.
- Als Bestandteil homöopathischer Mittel.
- Verschüttete Säuren beseitigen.
- Es wird auch in der Zuckerindustrie zur Herstellung von Rübenzucker verwendet.
- Baumaterialien.
- Elektrische und elektronische Produkte.
- Bodenbeläge.
Verweise
- BARIUMHYDROXID-MONOHYDRAT. (2016). Aus Cameochemikalien gewonnen: Cameochemicals.noaa.gov.
- Bariumhydroxid. (S.F.). Vom Chemielerner wiederhergestellt: Chemistrylearner.com.
- BARIUMHYDROXID. (S.F.). Von chemicalland21 wiederhergestellt: chemicalland21.com.
- IndiaMART InterMESH Ltd… (S.F.). Bariumhydroxid. Von indiamart wiederhergestellt: dir.indiamart.com.
- V. Sinisterra, A. F. (1987). Ba (OH) 2 als Katalysator in organischen Reaktionen. 17. Grenzflächen-Fest-Flüssig-Wittig-Horner-Reaktion unter sonochemischen Bedingungen. Das Journal of Organic Chemistry 52 (17), 3875-3879. researchgate.net.
- Sicherheitsdatenblatt Bariumhydroxid-Monohydrat. (2013, 21. Mai). Von sciencelab abgerufen: sciencelab.com/msds.
- J. Mendham, R. C. Denney, J. D. Barnes & M. J. Thomas (2000). Vogel's Quantitative Chemical Analysis (6. Aufl.). New York: Prentice Hall.
- Nationales Zentrum für Informationen zur Biotechnologie. (2017, 28. März). PubChem Compound Database; CID = 16211219. Von PubChem wiederhergestellt: pubchem.ncbi.nlm.nih.gov.
- Royal Society of Chemistry. (2015). Bariumhydroxid. Von chemspider wiederhergestellt: chemspider.com.
- Royal Society of Chemistry. (2015). Bariumhydroxidhydrat (1: 2: 1). Von chemspider wiederhergestellt: chemspider.com.
- Royal Society of Chemistry. (2015). Dihydroxybariumhydrat (1: 1). Von chemspider wiederhergestellt: chemspider.com.
- Royal Society of Chemistry. (2017). Endotherme Fest-Fest-Reaktionen. Wiederhergestellt von: Learn-Chemistry: rsc.org.

Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.