
Eigenschaften, Reaktivität und Verwendung von Calciumhydrid (CaH2)

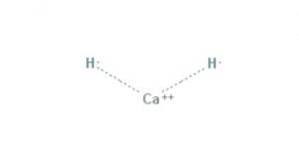
Das Calciumhydrid Es ist eine chemische Verbindung mit der Formel CaH2, die es zu einem Erdalkalihydrid macht. Diese chemische Verbindung hat zwei Ionenbindungen zwischen Calcium und den beiden Hydridionen, wie in Abbildung 1 gezeigt.
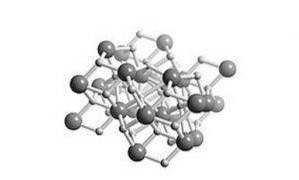
Es ist ein Salzhydrid, was bedeutet, dass seine Struktur dem von Salz ähnlich ist. Seine kristalline Struktur ist die gleiche wie die von Bleichlorid (Cotunnitmineral), wie in Abbildung 2 gezeigt.
Alle Alkali- und Erdalkalimetalle bilden Hydridsalze. In der Chemie ist ein Hydrid das Anion von Wasserstoff, H- oder häufiger eine Verbindung, in der ein oder mehrere Wasserstoffzentren nukleophile, reduzierende oder basische Eigenschaften aufweisen.
In Verbindungen, die als Hydride betrachtet werden, ist das Wasserstoffatom an ein elektropositiveres Element oder eine Gruppe gebunden.
Es kann durch Umsetzung von Calcium und Wasserstoff bei einer Temperatur zwischen 300 und 400 Grad Celsius hergestellt werden. Eine andere Möglichkeit, Calciumhydrid herzustellen, besteht darin, Calciumchlorid zusammen mit Wasserstoff und metallischem Natrium zu erhitzen. Die Reaktion läuft wie folgt ab:
CaCl2 + H2 + 2Na → CaH2 + 2NaCl
Bei dieser Reaktion bilden Calcium (Ca) und Wasserstoff (H) ein Calciumhydridmolekül, während Natriumatome zusammen mit Chlor Natriumchloridmoleküle (NaCl) bilden..
Calciumhydrid kann auch durch Reduktion von Calciumoxid (CaO) mit Magnesium (Mg) hergestellt werden. Die Reaktion wird in Gegenwart von Wasserstoff durchgeführt. Diese Reaktion erzeugt auch Magnesiumoxid (MgO). Nachfolgend finden Sie die Formel für diese chemische Reaktion:
CaO + Mg + H2 → CaH2 + MgO
Artikelverzeichnis
- 1 Physikalische und chemische Eigenschaften von Calciumhydrid
- 2 Reaktivität und Gefahren
- 3 Handhabung und Lagerung
- 4 Verwendungen und Anwendungen
- 4.1 Trockenmittel
- 4.2 Wasserstoffproduktion
- 4.3 Reduktionsmittel
- 5 Nachteil bei der Verwendung von Calciumhydrid
- 6 Referenzen
Physikalische und chemische Eigenschaften von Calciumhydrid
Calciumhydrid ist eine Reihe von Kristallen mit einer orthorhombischen Struktur von weißer Farbe, wenn sie rein sind. Im Allgemeinen ist es selten, es in dieser Form zu finden, so dass es normalerweise einen gräulichen Farbton hat. Es fehlt ein charakteristischer Geruch. Sein Aussehen ist in Abbildung 3 dargestellt (Royal Society of Chemistry, 2015)..

Es hat ein Molekulargewicht von 42,094 g / mol, einen Schmelzpunkt von 816 Grad Celsius und eine Dichte von 1,70 g / ml. Wenn es sich in Wasser löst, reagiert es heftig unter Bildung von Wasserstoff. Reagiert auch mit Alkohol (Nationales Zentrum für Biotechnologie-Informationen., S.F.).
Reaktivität und Gefahren
Calciumhydrid ist eine stabile Chemikalie, obwohl es sehr reaktiv auf Wasser oder Feuchtigkeit reagiert. Bei Kontakt mit Wasser werden brennbare Wasserstoffgase freigesetzt, die sich spontan entzünden können.
Es wird als explosive Verbindung angesehen. Beim Erhitzen in einer Reaktion mit Tetrahydrofuran kann es zu einer Explosion kommen. Wenn es mit Chlorat, Hypochlorit, Bromat, Kaliumperchlorat gemischt wird, wird es empfindlich gegen Hitze, Reibung und wird explosiv (Calciumhydrid 7789-78-8, 2016)..
Wenn Silberfluorid mit Calciumhydrid zerkleinert wird, wird die Masse weißglühend. Eine starke Erwärmung des Hydrids mit Chlor, Brom oder Jod führt zu einer Glühbirne.
Gemische des Hydrids mit verschiedenen Bromataten, beispielsweise Bariumbromat oder Chloraten, beispielsweise Bariumchlorat und Perchloraten wie Kaliumperchlorat, explodieren beim Mahlen. CaH2 reagiert bei Reibung weißglühend mit Silberfluorid.
Diese Verbindung muss unter einer inerten Atmosphäre gehandhabt werden. Bei unsachgemäßer Handhabung kann dies eine ernsthafte Gefahr für die Gesundheit und Sicherheit des Laborpersonals, der Ersthelfer und der Entsorger chemischer Abfälle darstellen (UC-Zentrum für Laborsicherheit, 2013)..
Extrem gefährlich bei Kontakt mit Haut oder Augen, da es reizend ist. Sehr gefährlich bei Hautkontakt, da er ätzend sein kann.
Es ist auch gefährlich bei Verschlucken und Einatmen. Das Ausmaß der Gewebeschädigung hängt von der Länge des Kontakts ab. Kontakt mit den Augen kann zu Hornhautschäden oder Blindheit führen..
Hautkontakt kann Entzündungen und Blasen verursachen. Das Einatmen von Staub führt zu Reizungen des Magen-Darm-Trakts oder der Atemwege, die durch Brennen, Niesen und Husten gekennzeichnet sind..
Schwere Überbelichtung kann zu Lungenschäden, Erstickung, Bewusstlosigkeit und sogar zum Tod führen. Eine Entzündung des Auges ist durch Rötung, Bewässerung und Juckreiz gekennzeichnet. Eine Entzündung der Haut ist durch Juckreiz, Peeling, Rötung oder gelegentliche Blasenbildung gekennzeichnet.
Wiederholte geringe Augenexposition kann zu Augenreizungen führen. Wiederholte Hautexposition kann zu lokaler Hautzerstörung oder Dermatitis führen..
Wiederholtes Einatmen von Staub kann zu unterschiedlich starker Reizung der Atemwege oder Lungenschäden führen. Wiederholtes oder längeres Einatmen von Staub kann zu chronischen Atemwegsreizungen führen (Sicherheitsdatenblatt Calciumhydrid MSDS, 2005)..
Bei Kontakt mit den Augen sollten sie sofort mindestens 15 Minuten lang mit viel Wasser gespült werden, wobei gelegentlich die oberen und unteren Augenlider angehoben werden..
Bei Hautkontakt sofort mindestens 15 Minuten lang mit viel Wasser abspülen, dabei kontaminierte Kleidung und Schuhe ausziehen..
Bei Verschlucken sollte kein Erbrechen ausgelöst werden. Eine Giftnotrufzentrale sollte angerufen werden. Es ist ratsam, den Ort der Exposition zu verlassen und sofort an die frische Luft zu gehen.
Bei Inhalation ist bei Atemnot Sauerstoff zuzuführen. Eine Mund-zu-Mund-Beatmung sollte nicht erfolgen, wenn das Opfer die Substanz verschluckt oder eingeatmet hat..
Die künstliche Beatmung sollte mit Hilfe einer Taschenmaske eingeleitet werden, die mit einem Einwegventil oder einem anderen geeigneten medizinischen Atemschutzgerät ausgestattet ist. In jedem Fall sollte sofort ein Arzt aufgesucht werden..
Handhabung und Lagerung
Die Verbindung sollte in einem trockenen Behälter vor Hitze geschützt aufbewahrt werden. Es sollte von Zündquellen ferngehalten werden. Staub sollte nicht eingeatmet werden. Diesem Produkt sollte kein Wasser zugesetzt werden
Tragen Sie bei unzureichender Belüftung geeignete Atemschutzgeräte wie eine Filtermaske. Bei Exposition einen Arzt aufsuchen und das Etikett nach Möglichkeit anbringen. Kontakt mit Haut und Augen vermeiden.
Brennbare Materialien sollten im Allgemeinen in einem separaten Sicherheitsschrank oder Lagerraum aufbewahrt werden. Halten Sie den Behälter fest verschlossen.
An einem kühlen und gut belüfteten Ort aufbewahren. Alle Geräte, die Material enthalten, müssen geerdet werden, um elektrische Funken zu vermeiden. Der Behälter sollte trocken und an einem kühlen Ort aufbewahrt werden.
Es ist ein nicht brennbares Material. Feuerwehrleute sollten jedoch geeignete Ausrüstung tragen, während sie ein Feuer um diese chemische Verbindung bekämpfen..
Es ist niemals ratsam, Wasser zu verwenden, um ein Feuer um Calciumhydrid zu löschen. Zu diesem Zweck können trockener Sand sowie Verbindungen wie Natriumchlorid und Natriumcarbonat verwendet werden..
Um Calciumhydridabfälle zu entfernen, muss es durch Zugabe von 25 ml Methanol pro Gramm Hydrid unter einer Stickstoffatmosphäre unter Rühren zersetzt werden..
Sobald die Reaktion abgeschlossen ist, wird der wässrigen Verbindung von Calciummethoxid das gleiche Volumen Wasser zugesetzt und mit viel Wasser im Abfluss entsorgt (National Research Council, 1995)..
Verwendungen und Anwendungen
Trockenmittel
Kaliumhydrid ist ein relativ mildes Trockenmittel. Aus diesem Grund ist die Verwendung dieser Verbindung als Trockenmittel sicherer als reaktivere Mittel wie Natrium-Kalium- und Natriummetalllegierungen. Reagiert mit Wasser wie folgt:
CaH 2 + 2 H 2 O → Ca (OH) 2 + 2 H 2
Die Hydrolyseprodukte dieser Reaktion, Wasserstoff (Gas) und Ca (OH) 2 (ein wässriges Gemisch), können nach einem Filtrations-, Destillations- oder Dekantierungsprozess vom chemischen Lösungsmittel abgetrennt werden..
Diese chemische Verbindung ist ein wirksames Trockenmittel für viele basische Lösungsmittel wie Amine und Pyridin. Wird manchmal zum Vortrocknen von Lösungsmitteln verwendet, bevor reaktivere Trockenmittel verwendet werden.
Wasserstoffproduktion
In den 1940er Jahren war diese Verbindung als Wasserstoffquelle unter dem Handelsnamen "Hydrolith" erhältlich..
Es wird seit langem als Wasserstoffquelle verwendet. Es wird immer noch zur Herstellung von reinem Wasserstoff in Laboratorien für verschiedene Experimente, fortschrittliche Brennstoffzellen und Batterieanwendungen verwendet (American Elements, S.F.).
Die Verbindung wird seit Jahrzehnten häufig als sicheres und bequemes Mittel zum Aufblasen von Wetterballons verwendet..
Es wird auch regelmäßig in Laboratorien verwendet, um kleine Mengen hochreinen Wasserstoffs für Experimente herzustellen. Der Feuchtigkeitsgehalt von Dieselkraftstoff wird aus dem nach der Behandlung mit CaH2 entwickelten Wasserstoff berechnet.
Reduktionsmittel
Beim Erhitzen zwischen 600 und 1000 Grad Celsius können Zirkonoxid, Niob, Uran, Chrom, Titan, Vanadium und Tantal reduziert werden, um das Pulver dieser Metalle herzustellen, so dass Calciumhydrid in der Metallurgie von Staub verwendet werden kann.
Die folgende Reaktion zeigt, wie Calciumhydrid als Reduktionsmittel wirkt:
TiO + 2CaH2 → CaO + H2 + Ti
Nachteil bei der Verwendung von Calciumhydrid
Diese chemische Verbindung ist oft die bevorzugte Wahl als Trocknungsmittel; Es hat jedoch auch einige Nachteile:
-Die Trocknungswirkung dieser Verbindung ist langsam, da sie in keinem Lösungsmittel löslich ist, mit dem sie nicht heftig reagiert..
-Diese pulverförmige Verbindung ist mit vielen Lösungsmitteln nicht kompatibel. Die Reaktion mit Chlorkohlenwasserstoffen kann sogar Explosionen verursachen.
-Es kann nicht zur Desoxygenierung von Lösungsmitteln verwendet werden, da es nicht in der Lage ist, gelösten Sauerstoff zu entfernen.
-Die Unterscheidung zwischen Calciumhydrid und Calciumhydroxid ist aufgrund ihres ähnlichen Aussehens ziemlich schwierig.
Verweise
- Amerikanische Elemente. (S.F.). Calciumhydrid. Abgerufen von americanelements.com: americanelements.com.
- Calciumhydrid 7789-78-8. (2016). Abgerufen von Chemicalbook.com: Chemicalbook.com.
- Calciumhydrid. (s.f.). Vom Chemielerner abgerufen: Chemistrylearner.com.
- Sicherheitsdatenblatt Calciumhydrid-Sicherheitsdatenblatt. (2005, 10. Oktober). Von sciencelab.com abgerufen: sciencelab.com.
- Nationales Zentrum für Informationen zur Biotechnologie. (S.F.). PubChem Compound Database; CID = 105052. Abgerufen von pubchem.ncbi.nlm.nih.gov: pubchem.ncbi.nlm.nih.gov.
- Nationaler Forschungs Rat. (1995). Umsichtige Praktiken im Labor: Handhabung und Entsorgung von Chemikalien. Washinton: NationalAacademy Press.
- Royal Society of Chemistry. (2015). Calciumhydrid ID 94784. Abgerufen von chemspider.com: chemspider.com.
- UC-Zentrum für Laborsicherheit. (2013, 18. Januar). Standardarbeitsanweisung Calciumhydrid. Abgerufen von chemengr.ucsb.edu: chemengr.ucsb.edu.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.