
Struktur, Eigenschaften und Verwendung von Berylliumhydrid (BeH2)
Das Berylliumhydrid Es ist eine kovalente Verbindung, die zwischen dem Erdalkalimetall Beryllium und Wasserstoff gebildet wird. Seine chemische Formel lautet BeHzwei, und da es kovalent ist, besteht es nicht aus Be-Ionenzwei+ noch H.-. Zusammen mit LiH ist es eines der leichtesten Metallhydride, die synthetisiert werden können.
Es wird durch Behandlung von Dimethylberyllium, Be (CH) hergestellt3)zwei, mit Lithiumaluminiumhydrid, LiAlH4. Das BeHzwei Reiner wird durch Pyrolyse von Di-tert-butylberyl Be (C (CH) erhalten3)3)zwei bei 210 ºC.

Als einzelnes Molekül im gasförmigen Zustand ist es in der Geometrie linear, im festen und flüssigen Zustand polymerisiert es jedoch in Anordnungen dreidimensionaler Netzwerke. Es ist unter normalen Bedingungen ein amorpher Feststoff und kann unter enormem Druck kristallin werden und metallische Eigenschaften aufweisen..
Es stellt eine mögliche Methode zur Speicherung von Wasserstoff dar, entweder als Wasserstoffquelle bei der Zersetzung oder als festes absorbierendes Gas. Das BeHzwei Aufgrund der stark polarisierenden Natur von Beryllium ist es sehr giftig und umweltschädlich.
Artikelverzeichnis
- 1 Chemische Struktur
- 1.1 BeH2-Molekül
- 1.2 BeH2-Ketten
- 1.3 Dreidimensionale Netzwerke von BeH2
- 2 Eigenschaften
- 2.1 Kovalenter Charakter
- 2.2 Chemische Formel
- 2.3 Aussehen
- 2.4 Löslichkeit in Wasser
- 2.5 Löslichkeit
- 2.6 Dichte
- 2.7 Reaktivität
- 3 Verwendungen
- 4 Referenzen
Chemische Struktur
BeH-Molekülzwei
Das erste Bild zeigt ein einzelnes Molekül Berylliumhydrid in gasförmigem Zustand. Beachten Sie, dass seine Geometrie linear ist und die H-Atome durch einen Winkel von 180 ° voneinander getrennt sind. Um diese Geometrie zu erklären, muss das Be-Atom eine sp-Hybridisierung aufweisen.
Beryllium hat zwei Valenzelektronen, die sich im 2s-Orbital befinden. Gemäß der Valenzbindungstheorie wird eines der Elektronen im 2s-Orbital energetisch zum 2p-Orbital befördert; Infolgedessen können Sie jetzt zwei kovalente Bindungen mit den beiden sp-Hybridorbitalen bilden.
Und was ist mit den restlichen freien Orbitalen des Be? Zwei weitere reine, nicht hybridisierte 2p-Orbitale sind verfügbar. Wenn sie leer sind, ist das BeHzwei Es ist eine elektronenarme Verbindung in gasförmiger Form; und deshalb kondensieren und kristallisieren ihre Moleküle, wenn sie abkühlen und zusammenklumpen, zu einem Polymer.
BeH Kettenzwei
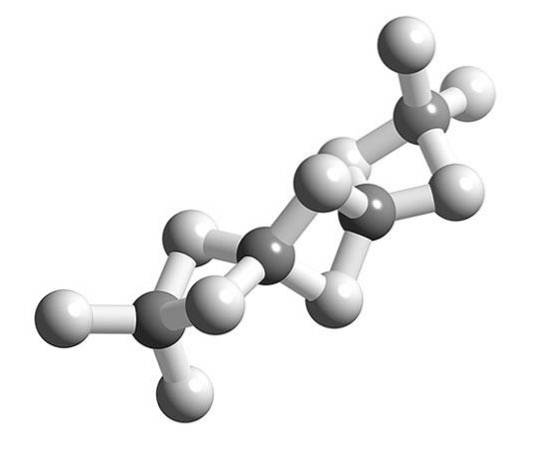
Wenn die BeH-Molekülezwei polymerisieren, hört die umgebende Geometrie des Be-Atoms auf, linear zu sein und wird tetraedrisch.
Zuvor wurde die Struktur dieses Polymers so modelliert, als wären es Ketten mit BeH-Einheitenzwei verbunden durch Wasserstoffbrücken (oberes Bild, mit den Kugeln in Weiß- und Grautönen). Im Gegensatz zu den Wasserstoffbrückenbindungen von Dipol-Dipol-Wechselwirkungen haben sie einen kovalenten Charakter.
In der Be-H-Be-Brücke des Polymers sind zwei Elektronen zwischen den drei Atomen verteilt (Link 3c, 2e), die theoretisch mit größerer Wahrscheinlichkeit um das Wasserstoffatom herum liegen sollte (elektronegativer).
Andererseits schafft es das von vier H umgebene Be, seine elektronische Lücke relativ zu füllen und sein Valenzoktett zu vervollständigen.
Hier verblasst die Valenzbindungstheorie, um eine relativ genaue Erklärung zu geben. Warum? Weil Wasserstoff nur zwei Elektronen haben kann und die -H- Bindung die Beteiligung von vier Elektronen implizieren würde.
Also, um die Be-H-Brücken zu erklärenzwei-Be (zwei graue Kugeln, die durch zwei weiße Kugeln verbunden sind) werden andere komplexe Modelle der Bindung benötigt, wie sie beispielsweise die Molekülorbitaltheorie liefert.
Es wurde experimentell gefunden, dass die Polymerstruktur von BeHzwei eigentlich keine Kette, sondern ein dreidimensionales Netzwerk.
Dreidimensionale Netzwerke von BeHzwei

Das obere Bild zeigt einen Ausschnitt aus dem dreidimensionalen Netzwerk von BeHzwei. Beachten Sie, dass die gelblich-grünen Kugeln, die Be-Atome, wie in der Kette ein Tetraeder bilden. In dieser Struktur gibt es jedoch eine größere Anzahl von Wasserstoffbrückenbindungen, und außerdem ist die Struktureinheit nicht länger das BeHzwei aber das BeH4.
Die gleichen Struktureinheiten BeHzwei und BeH4 zeigen an, dass es eine größere Häufigkeit von Wasserstoffatomen im Netzwerk gibt (4 H-Atome für jedes Be).
Dies bedeutet, dass Beryllium innerhalb dieses Netzwerks seine elektronische Leerstelle noch mehr als innerhalb einer kettenartigen Polymerstruktur liefern kann..
Und als offensichtlichster Unterschied dieses Polymers in Bezug auf das einzelne Molekül von BeHzwei, ist, dass das Be notwendigerweise eine sp-Hybridisierung haben muss3 (normalerweise) um tetraedrische und nichtlineare Geometrien zu erklären.
Eigenschaften
Kovalenter Charakter
Warum ist Berylliumhydrid eine kovalente und nichtionische Verbindung? Die Hydride der anderen Elemente der Gruppe 2 (Herr Becamgbara) sind ionisch, dh sie bestehen aus Feststoffen, die durch ein Kation M gebildet werdenzwei+ und zwei Hydridanionen H.- (MgHzwei, CaHzwei, Bahzwei). Daher ist das BeHzwei besteht nicht aus Bezwei+ noch H.- elektrostatisch interagieren.
Das Kation Bezwei+ es zeichnet sich durch seine hohe Polarisationskraft aus, die die elektronischen Wolken der umgebenden Atome verzerrt.
Infolge dieser Verzerrung werden die Anionen H.- sie sind gezwungen, kovalente Bindungen zu bilden; Links, die den Eckpfeiler der gerade erläuterten Strukturen bilden.
Chemische Formel
BeHzwei oder (BeHzwei) n
Aussehen
Farbloser amorpher Feststoff.
Wasserlöslichkeit
Es zersetzt sich.
Löslichkeit
Unlöslich in Diethylether und Toluol.
Dichte
0,65 g / cm³ (1,85 g / l). Der erste Wert kann sich auf die Gasphase und der zweite auf den polymeren Feststoff beziehen.
Reaktivität
Reagiert langsam mit Wasser, wird jedoch durch HCl schnell unter Bildung von Berylliumchlorid, BeCl, hydrolysiertzwei.
Berylliumhydrid reagiert mit Lewis-Basen, insbesondere Trimethylamin, N (CH3)3, unter Bildung von Hydriden ein dimeres Addukt zu bilden.
Es kann auch mit Dimethylamin unter Bildung von trimerem Berylliumdiamid reagieren [Be (N (CH3)zwei)zwei]]3 und Wasserstoff. Die Reaktion mit Lithiumhydrid, wo das H-Ion- ist die Lewis-Base, bildet nacheinander LIBeH3 und LizweiBeH4.
Anwendungen
Berylliumhydrid könnte einen vielversprechenden Weg darstellen, um molekularen Wasserstoff zu speichern. Wenn sich das Polymer zersetzt, würde es H freisetzenzwei, das würde als Raketentreibstoff dienen. Bei diesem Ansatz würde das dreidimensionale Netzwerk mehr Wasserstoff speichern als die Ketten.
Ebenso gibt es, wie im Bild des Netzwerks zu sehen ist, Poren, die es ermöglichen würden, die H-Moleküle unterzubringen.zwei.
Tatsächlich simulieren einige Studien, wie eine solche physische Speicherung in BeH aussehen würdezwei kristallin; das heißt, das Polymer ist enormen Drücken ausgesetzt, und was wären seine physikalischen Eigenschaften mit unterschiedlichen Mengen an adsorbiertem Wasserstoff.
Verweise
- Wikipedia. (2017). Berylliumhydrid. Wiederhergestellt von: en.wikipedia.org
- Armstrong, D. R., Jamieson, J. & Perkins, P.G. Theoret. Chim. Acta (1979) Die elektronischen Strukturen von polymerem Berylliumhydrid und polymerem Borhydrid. 51: 163. doi.org/10.1007/BF00554099
- Kapitel 3: Berylliumhydrid und seine Oligomere. Wiederhergestellt von: shodhganga.inflibnet.ac.in
- Vikas Nayak, Suman Banger und U. P. Verma. (2014). Untersuchung des strukturellen und elektronischen Verhaltens von BeHzwei als Wasserstoffspeicherverbindung: Ein Ab-initio-Ansatz. Konferenzbeiträge in der Wissenschaft, vol. 2014, Artikel-ID 807893, 5 Seiten. doi.org/10.1155/2014/807893
- Shiver & Atkins. (2008). Anorganische Chemie. In den Elementen der Gruppe 1. (Vierte Ausgabe). Mc Graw Hill.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.