
Eigenschaften, Typen und Mechanismen der katalytischen Hydrierung
Das katalytische Hydrierung Es ist die Reaktion, durch die molekularer Wasserstoff mit höheren Geschwindigkeiten zu einer Verbindung gegeben wird. Das H-Molekülzwei Es muss nicht nur zuerst seine kovalente Bindung aufbrechen, sondern es ist auch weniger wahrscheinlich, dass es so klein und effizient ist, dass es effizient kollidiert..
Die Wasserstoffrezeptorverbindung kann entweder organisch oder anorganisch sein. In organischen Verbindungen finden sich die meisten Beispiele für katalytische Hydrierung; insbesondere solche, die pharmakologische Aktivität aufweisen oder deren Strukturen Metalle enthalten (metallorganische Verbindungen).
Was passiert, wenn H hinzugefügt wird?zwei zu einer Struktur voller Kohlenstoff? Seine Ungesättigtheit nimmt ab, dh Kohlenstoff erreicht den maximalen Grad an einfachen Bindungen, den er bilden kann.
Daher ist die H.zwei es wird zu den Doppelbindungen (C = C) und Dreifachbindungen (C≡C) hinzugefügt; obwohl es auch zu Carbonylgruppen hinzugefügt werden kann (C = O).
Somit reagieren die zugesetzten Alkene und Alkine durch katalytische Hydrierung. Durch oberflächliche Analyse einer Struktur kann vorhergesagt werden, ob H hinzugefügt wird oder nichtzwei nur durch den Nachweis von Doppel- und Dreifachbindungen.
Artikelverzeichnis
- 1 Eigenschaften der katalytischen Hydrierung
- 1.1 Wasserstoffbrückenbrüche
- 1.2 Experimentell
- 2 Arten
- 2.1 Homogen
- 2.2 Heterogen
- 3 Mechanismus
- 4 Referenzen
Eigenschaften der katalytischen Hydrierung
Das Bild zeigt den Mechanismus dieser Reaktion. Es ist jedoch notwendig, einige theoretische Aspekte zu behandeln, bevor sie beschrieben werden.
Die Oberflächen der grauen Kugeln stellen die Metallatome dar, die, wie zu sehen sein wird, die Katalysatoren der Hydrierung schlechthin sind..
Wasserstoffbrücken brechen
Die Hydrierung ist zunächst eine exotherme Reaktion, dh sie setzt durch die Bildung von Verbindungen mit geringerer Energie Wärme frei..
Dies erklärt sich aus der Stabilität der gebildeten CH-Bindungen, die für ihr anschließendes Aufbrechen mehr Energie benötigen als die für die H-H-Bindung von molekularem Wasserstoff erforderliche..
Andererseits beinhaltet die Hydrierung immer zuerst das Aufbrechen der H-H-Bindung. Dieser Bruch kann homolytisch sein, wie es in vielen Fällen vorkommt:
H-H => H ∙ + ∙ H.
Oder heterolytisch, was beispielsweise auftreten kann, wenn Zinkoxid, ZnO, hydriert wird:
H-H => H.+ + H.-
Beachten Sie, dass der Unterschied zwischen den beiden Brüchen darin besteht, wie die Elektronen in der Bindung verteilt sind. Wenn sie gleichmäßig (kovalent) verteilt sind, konserviert jedes H ein Elektron; Wenn die Partition ionisch ist, endet man ohne Elektronen, H.+, und der andere gewinnt sie vollständig, H.-.
Beide Brüche sind bei der katalytischen Hydrierung möglich, obwohl durch die Homolytik ein logischer Mechanismus dafür entwickelt werden kann..
Experimental
Wasserstoff ist ein Gas und muss daher perlen gelassen werden und es muss sichergestellt sein, dass nur er auf der Oberfläche der Flüssigkeit vorherrscht..
Andererseits muss die zu hydrierende Verbindung in einem Medium gelöst werden, sei es Wasser, Alkohol, Ether, Ester oder ein flüssiges Amin; Andernfalls würde die Hydrierung sehr langsam ablaufen.
Wenn die zu hydrierende Verbindung gelöst wird, muss sich auch ein Katalysator im Reaktionsmedium befinden. Dies ist für die Beschleunigung der Reaktionsgeschwindigkeit verantwortlich.
Bei der katalytischen Hydrierung werden häufig feinteilige Metalle aus Nickel, Palladium, Platin oder Rhodium verwendet, die in fast allen organischen Lösungsmitteln unlöslich sind. Daher gibt es zwei Phasen: eine flüssige, in der die Verbindung und der Wasserstoff gelöst sind, und eine feste, die des Katalysators..
Diese Metalle bilden ihre Oberfläche für die Reaktion des Wasserstoffs und der Verbindung, so dass das Aufbrechen von Bindungen beschleunigt wird..
Ebenso verringern sie den Diffusionsraum der Spezies und erhöhen die Anzahl effektiver molekularer Kollisionen. Darüber hinaus findet die Reaktion in den Poren des Metalls statt..
Typen
Homogen
Wir sprechen von einer homogenen katalytischen Hydrierung, wenn das Reaktionsmedium aus einer einzigen Phase besteht. Hier gibt es keinen Platz für die Verwendung von Metallen in ihren reinen Zuständen, da sie unlöslich sind.
Stattdessen werden metallorganische Verbindungen dieser Metalle verwendet, die löslich sind und nachweislich hohe Ausbeuten aufweisen..
Eine dieser metallorganischen Verbindungen ist Wilkinsons Katalysator: Tris (triphenylphosphin) rhodiumchlorid, [(C.6H.5)3P]3RhCl. Diese Verbindungen bilden mit H einen Komplexzwei, Aktivierung für die anschließende Additionsreaktion zu Alken oder Alkin.
Die homogene Hydrierung bietet viel mehr Alternativen als die heterogene. Warum? Da die Chemie die metallorganischen Verbindungen ist, gibt es viele: Es reicht aus, das Metall (Pt, Pd, Rh, Ni) und die Liganden (die organischen oder anorganischen Moleküle, die an das Metallzentrum gebunden sind) zu wechseln, um einen neuen Katalysator zu erhalten.
Heterogen
Die heterogene katalytische Hydrierung besteht, wie gerade erwähnt, aus zwei Phasen: einer flüssigen und einer festen..
Neben metallischen Katalysatoren gibt es andere, die aus einer festen Mischung bestehen; Zum Beispiel Lindlars Katalysator, der aus Platin, Calciumcarbonat, Bleiacetat und Chinolin besteht.
Der Lindlar-Katalysator weist die Besonderheit auf, dass ihm die Hydrierung von Alkenen fehlt; Es ist jedoch sehr nützlich für partielle Hydrierungen, dh es funktioniert hervorragend bei Alkinen:
RC≡CR + H.zwei => RHC = CHR
Mechanismus
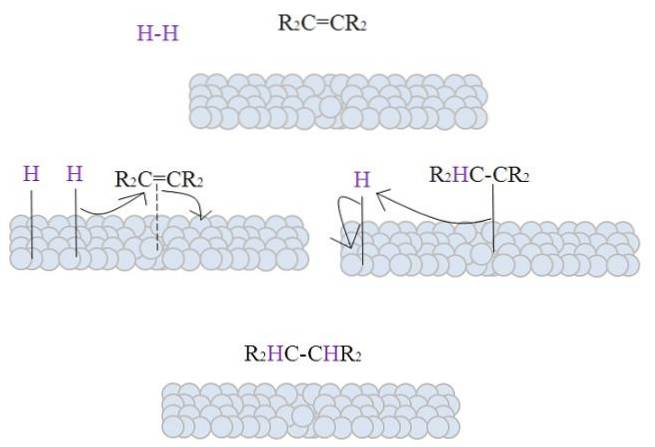
Das Bild zeigt den Mechanismus der katalytischen Hydrierung unter Verwendung von Metallpulver als Katalysator.
Die grauen Kugeln entsprechen der metallischen Oberfläche von beispielsweise Platin. Das Molekül H.zwei (violette Farbe) nähert sich der Metalloberfläche an, ebenso wie tetra-substituiertes Alken R.zweiC = CRzwei.
Die H.zwei es interagiert mit den Elektronen, die sich durch die Atome des Metalls bewegen, und es kommt zum Bruch und zur Bildung einer temporären H-M-Bindung, wobei M das Metall ist. Dieser Vorgang ist bekannt als Chemisorption;; das heißt, eine Adsorption durch chemische Kräfte.
Alken interagiert auf ähnliche Weise, aber die Bindung wird durch seine Doppelbindung (gepunktete Linie) gebildet. Die H-H-Bindung ist bereits dissoziiert und jedes Wasserstoffatom bleibt an das Metall gebunden; in gleicher Weise geschieht dies mit den metallischen Zentren in den metallorganischen Katalysatoren, wobei ein Zwischenkomplex H-M-H gebildet wird.
Dann gibt es eine Wanderung eines H in Richtung der Doppelbindung, und diese öffnet sich und bildet eine Bindung mit dem Metall. Das verbleibende H bindet dann an den anderen Kohlenstoff der ursprünglichen Doppelbindung, und das erzeugte Alkan R wird schließlich freigesetzt.zweiHC-CHRzwei.
Dieser Mechanismus wird so oft wie nötig wiederholt, bis alle H.zwei vollständig reagiert haben.
Verweise
- Graham Solomons T. W., Craig B. Fryhle. (2011). Organische Chemie. Amine. (10th Auflage.). Wiley plus.
- Carey F. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Lew J. (s.f.). Katalytische Hydrierung von Alkenen. Chemie LibreTexts. Wiederhergestellt von: chem.libretexts.org
- Jones D. (2018). Was ist katalytische Hydrierung? - Mechanismus & Reaktion. Studie. Wiederhergestellt von: study.com



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.