
Eigenschaften und Beispiele für ungesättigte Kohlenwasserstoffe

Das ungesättigte Kohlenwasserstoffe sind solche, die mindestens eine Kohlenstoffdoppelbindung in ihrer Struktur enthalten und eine Dreifachbindung enthalten können, da die Sättigung einer Kette bedeutet, dass sie alle möglichen Wasserstoffatome in jedem Kohlenstoff erhalten hat und es dort keine Paare freier Elektronen gibt es können mehr Wasserstoffatome eintreten.
Ungesättigte Kohlenwasserstoffe werden in zwei Typen unterteilt: Alkene und Alkine. Alkene sind Kohlenwasserstoffverbindungen, die eine oder mehrere Doppelbindungen in ihrem Molekül aufweisen. Inzwischen sind Alkine Kohlenwasserstoffverbindungen, die eine oder mehrere Dreifachbindungen in ihrer Formel aufweisen..
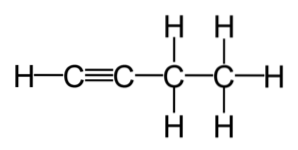
Alkene und Alkine werden häufig kommerziell verwendet. Dies sind Verbindungen mit einer höheren Reaktivität als gesättigte Kohlenwasserstoffe, was sie zum Ausgangspunkt vieler Reaktionen macht, die aus den häufigsten Alkenen und Alkinen erzeugt werden..
Artikelverzeichnis
- 1 Nomenklatur
- 1.1 Nomenklatur der Alkene
- 1.2 Nomenklatur der Alkine
- 2 Eigenschaften
- 2.1 Doppel- und Dreifachbindungen
- 2.2 cis-trans-Isomerisierung
- 2.3 Säure
- 2.4 Polarität
- 2.5 Siede- und Schmelzpunkte
- 3 Beispiele
- 3.1 Ethylen (C2H4)
- 3.2 Ethin (C2H2)
- 3.3 Propylen (C3H6)
- 3.4 Cyclopenten (C5H8)
- 4 Artikel von Interesse
- 5 Referenzen
Nomenklatur
Ungesättigte Kohlenwasserstoffe werden unterschiedlich benannt, je nachdem, ob es sich um Alkene oder Alkine handelt, wobei die Suffixe "-eno" und "-ino" verwendet werden..
Alkene haben mindestens eine Kohlenstoff-Kohlenstoff-Doppelbindung in ihrer Struktur und haben die allgemeine Formel C.nH.2n, während Alkine mindestens eine Dreifachbindung enthalten und nach der Formel C gehandhabt werdennH.2n-2.
Nomenklatur der Alkene
Um Alkene zu benennen, müssen die Positionen der Kohlenstoff-Kohlenstoff-Doppelbindungen angegeben werden. Die Namen chemischer Verbindungen, die C = C-Bindungen enthalten, enden mit dem Suffix "-eno"..
Wie bei Alkanen wird der Name der Basenverbindung durch die Anzahl der Kohlenstoffatome in der längsten Kette bestimmt. Zum Beispiel das Molekül CHzwei= CH-CHzwei-CH3 wird "1-Buten" genannt, aber das von H.3C-CH = CH-CH3 wird sich "2-Buten" nennen.
Die Zahlen, die in den Namen dieser Verbindungen beobachtet werden, geben das Kohlenstoffatom mit der kleinsten Zahl in der Kette an, in der sich die C = C-Bindung des Alkens befindet..
Die Anzahl der Kohlenstoffe in dieser Kette gibt das Präfix des Namens an, ähnlich wie bei Alkanen ("met-", "et-", "pro-", "but-" usw.), jedoch immer mit dem Suffix "-eno" "".
Es muss auch angegeben werden, ob das Molekül cis oder trans ist, bei denen es sich um Arten von geometrischen Isomeren handelt. Dies wird im Namen hinzugefügt, wie 3-Ethyl-cis-2-heptan oder 3-Ethyl-trans-2-heptan.
Nomenklatur der Alkine
Um die Namen chemischer Verbindungen zu erraten, die dreifache C≡C-Bindungen enthalten, wird der Name der Verbindung durch die Anzahl der C-Atome in der längsten Kette bestimmt.
Ähnlich wie bei Alkenen geben die Namen der Alkine die Position an, an der sich die Kohlenstoff-Kohlenstoff-Dreifachbindung befindet. zum Beispiel in den Fällen von HC≡C-CHzwei-CH3, oder "1-Butin" und H.3C-C≡C-CH3, oder "2-Butin".
Eigenschaften
Ungesättigte Kohlenwasserstoffe umfassen eine enorme Anzahl verschiedener Moleküle, weshalb sie eine Reihe von Eigenschaften aufweisen, die sie definieren und nachstehend aufgeführt sind:
Doppel- und Dreifachbindungen
Die Doppel- und Dreifachbindungen von Alkenen und Alkinen weisen spezielle Eigenschaften auf, die sie von Einfachbindungen unterscheiden: Eine Einfachbindung stellt die schwächste der drei dar und wird durch eine Sigma-Bindung zwischen zwei Molekülen gebildet.
Die Doppelbindung wird durch eine Sigma-Bindung und ein Pi und die Dreifachbindung durch eine Sigma-Bindung und zwei Pi gebildet. Dies macht die Alkene und Alkine stärker und benötigt mehr Energie, um bei Reaktionen abzubauen..
Darüber hinaus betragen die Bindungswinkel, die in einer Doppelbindung gebildet werden, 120 °, während die der Dreifachbindung 180 ° betragen. Dies bedeutet, dass Moleküle mit Dreifachbindungen einen linearen Winkel zwischen diesen beiden Kohlenstoffen haben..
Cis-trans-Isomerisierung
In Alkenen und anderen Verbindungen mit Doppelbindungen tritt eine geometrische Isomerisierung auf, die sich auf der Seite der Bindungen unterscheidet, in der sich die funktionellen Gruppen befinden, die an die an dieser Doppelbindung beteiligten Kohlenstoffe gebunden sind..
Wenn die funktionellen Gruppen eines Alkens in Bezug auf die Doppelbindung in die gleiche Richtung orientiert sind, wird dieses Molekül als cis bezeichnet, aber wenn die Substituenten in verschiedene Richtungen weisen, wird es als trans bezeichnet.
Diese Isomerisierung ist kein einfacher Ortsunterschied; Verbindungen können stark variieren, nur weil sie cis-Geometrie oder trans-Geometrie sind.
Cis-Verbindungen beinhalten normalerweise Dipol-Dipol-Kräfte (die in transs einen Nettowert von Null haben); Darüber hinaus haben sie eine höhere Polarität, Siede- und Schmelzpunkte und eine höhere Dichte als ihre trans-Gegenstücke. Darüber hinaus sind trans-Verbindungen stabiler und setzen weniger Verbrennungswärme frei..
Säure
Alkene und Alkine haben aufgrund der Polarität ihrer Doppel- und Dreifachbindungen im Vergleich zu Alkanen eine höhere Acidität. Sie sind weniger sauer als Alkohole und Carbonsäuren; und von den beiden sind Alkine saurer als Alkene.
Polarität
Die Polarität von Alkenen und Alkinen ist gering, insbesondere bei trans-Alkenverbindungen, wodurch diese Verbindungen in Wasser unlöslich werden..
Ungesättigte Kohlenwasserstoffe lösen sich jedoch leicht in üblichen organischen Lösungsmitteln wie Ethern, Benzol, Tetrachlorkohlenstoff und anderen Verbindungen mit niedriger oder keiner Polarität..
Siede- und Schmelzpunkte
Aufgrund ihrer geringen Polarität sind die Siede- und Schmelzpunkte ungesättigter Kohlenwasserstoffe niedrig und entsprechen fast denen von Alkanen mit derselben Kohlenstoffstruktur..
Trotzdem haben Alkene niedrigere Siede- und Schmelzpunkte als die entsprechenden Alkane und können, wie bereits erwähnt, noch stärker abnehmen, wenn sie cis-isomer sind..
Im Gegensatz dazu haben Alkine höhere Siede- und Schmelzpunkte als Alkane und die entsprechenden Alkene, obwohl der Unterschied nur wenige Grad beträgt..
Schließlich haben Cycloalkene aufgrund der Steifheit der Doppelbindung auch niedrigere Schmelztemperaturen als die entsprechenden Cycloalkane..
Beispiele
Ethylen (C.zweiH.4)
Eine starke chemische Verbindung, unter anderem aufgrund ihrer Polymerisations-, Oxidations- und Halogenierungskapazität.
Ethyne (C.zweiH.zwei)
Auch als Acetylen bezeichnet, ist es ein brennbares Gas, das als nützliche Licht- und Wärmequelle verwendet wird..
Propylen (C.3H.6)
Es ist die zweithäufigste Verbindung in der chemischen Industrie weltweit und eines der Produkte der Erdölthermolyse.
Cyclopenten (C.5H.8)
Eine Verbindung vom Cycloalken-Typ. Diese Substanz wird als Monomer für die Synthese von Kunststoffen verwendet.
Artikel von Interesse
Gesättigte Kohlenwasserstoffe oder Alkane.
Verweise
- Chang, R. (2007). Chemie, 9. Auflage. Mexiko: McGraw-Hill.
- Wikipedia. (s.f.). Alkene. Abgerufen von en.wikipedia.org
- Boudreaux, K. A. (s.f.). Ungesättigte Kohlenwasserstoffe. Von angelo.edu abgerufen
- Tuckerman, M. E. (s.f.). Alkene und Alkine. Abgerufen von nyu.edu
- Universität, L. T. (s.f.). Die ungesättigten Kohlenwasserstoffe: Alkene und Alkine. Abgerufen von chem.latech.edu


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.