
Struktur, Eigenschaften und Verwendung von Heptan (C7H16)
Das Heptan ist eine organische Verbindung mit der chemischen Formel C.7H.16 und umfasst neun Strukturisomere, von denen das bekannteste linear ist. Es ist ein Kohlenwasserstoff, insbesondere ein Alkan oder Paraffin, das in den meisten Laboratorien für organische Chemie in Lehre oder Forschung vorkommt..
Im Gegensatz zu anderen paraffinischen Lösungsmitteln weist Heptan eine geringere Flüchtigkeit auf, was die Verwendung relativ sicherer macht. vorausgesetzt, Ihre Dämpfe sind von keiner Wärmequelle umgeben und Sie arbeiten in einer Dunstabzugshaube. Abgesehen von seiner Entflammbarkeit ist es eine Verbindung, die inert genug ist, um als Medium für organische Reaktionen zu dienen..
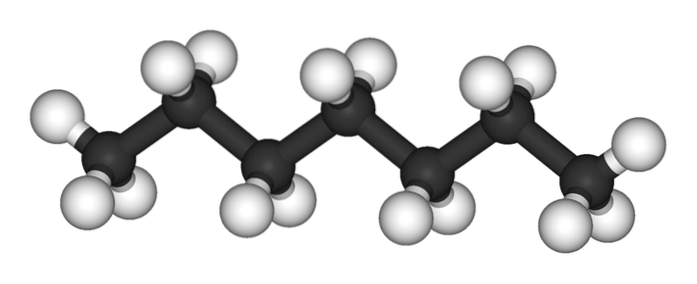
Das obere Bild zeigt die Struktur des n-Heptan, das lineare Isomer aller Heptane. Da es das gebräuchlichste und kommerziell wertvollste Isomer ist und am einfachsten zu synthetisieren ist, versteht es sich, dass sich der Begriff "Heptan" ausschließlich auf dieses bezieht n-Heptan; wenn nicht anders angegeben.
Die Flaschen dieser flüssigen Verbindung geben jedoch an, dass sie enthält n-Heptan. Sie müssen in einer Dunstabzugshaube freigelegt und sorgfältig gemessen werden.
Es ist ein ausgezeichnetes Lösungsmittel für Fette und Öle, weshalb es häufig bei der Extraktion von Pflanzenessenzen oder anderen Naturstoffen verwendet wird..
Artikelverzeichnis
- 1 Struktur
- 1.1 n-Heptan und seine intermolekularen Wechselwirkungen
- 1.2 Isomere
- 2 Eigenschaften von Heptan
- 2.1 Aussehen
- 2,2 Molmasse
- 2.3 Schmelzpunkt
- 2.4 Siedepunkt
- 2,5 Dampfdruck
- 2.6 Dichte
- 2.7 Löslichkeit in Wasser
- 2.8 Löslichkeit in anderen Lösungsmitteln
- 2.9 Brechungsindex (nD)
- 2.10 Viskosität
- 2.11 Wärmekapazität
- 2.12 Flammpunkt
- 2.13 Selbstentzündungstemperatur
- 2.14 Oberflächenspannung
- 2.15 Verbrennungswärme
- 2.16 Reaktivität
- 3 Verwendungen
- 3.1 Lösungsmittel und Reaktionsmedium
- 3.2 Fällungsmittel
- 3,3 Oktan
- 4 Referenzen
Struktur
n-Heptan und seine intermolekularen Wechselwirkungen
Wie im ersten Bild zu sehen ist, ist das Molekül von n-Heptan ist linear und aufgrund der chemischen Hybridisierung seiner Kohlenstoffatome nimmt die Kette eine Zick-Zack-Form an. Dieses Molekül ist dynamisch, da sich seine C-C-Bindungen drehen können, wodurch sich die Kette in verschiedenen Winkeln leicht biegt. Dies trägt zu ihren intermolekularen Wechselwirkungen bei..
Das n-Heptan ist ein unpolares, hydrophobes Molekül, und daher basieren seine Wechselwirkungen auf den Londoner Dispersionskräften; Dies sind diejenigen, die von der Molekülmasse der Verbindung und ihrer Kontaktfläche abhängen. Zwei Moleküle von n-Heptan nähert sich einander so, dass sie ihre Ketten übereinander „keilen“.
Diese Wechselwirkungen sind effektiv genug, um die Moleküle von zu halten n-Heptan kohäsiv in einer Flüssigkeit, die bei 98 ºC kocht.
Isomere
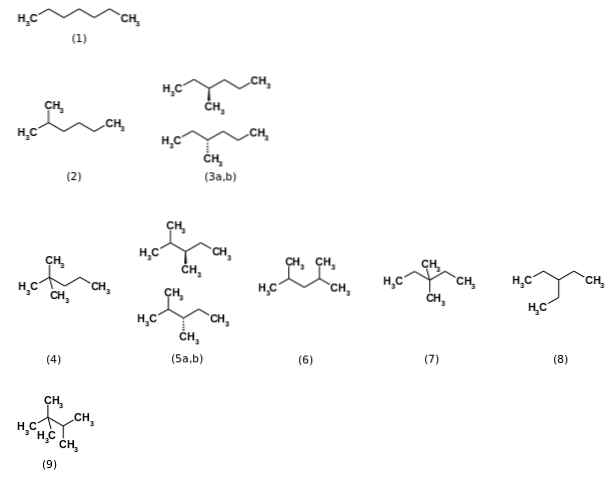
Zuerst wurde gesagt, dass die Formel C.7H.16 stellten insgesamt neun Strukturisomere dar, wobei die n-Heptan am relevantesten (1). Die anderen acht Isomere sind im obigen Bild dargestellt. Beachten Sie auf einen Blick, dass einige stärker verzweigt sind als andere. Von links nach rechts, von oben beginnend, haben wir:
(2): 2-Methylhexan
(3): 3-Methylhexan, das aus einem Paar Enantiomeren (a und b) besteht
(4): 2,2-Dimethylpentan, auch als Neoheptan bekannt
(5): 2,3-Dimethylpentan, wiederum mit einem Paar Enantiomeren
(6): 2,4-Dimethylpentan
(7): 3,3-Dimethylpentan
(8): 3-Ethylpentan
(9): 2,2,3-Trimethylbutan.
Jedes dieser Isomere hat Eigenschaften und Anwendungen unabhängig von der n-Heptan, hauptsächlich für organische Synthesebereiche reserviert.
Heptaneigenschaften
Aussehen
Farblose Flüssigkeit mit benzinartigem Geruch.
Molmasse
100,205 g / mol
Schmelzpunkt
-90.549 ºC, wird zu einem Molekülkristall.
Siedepunkt
98,38 ºC.
Dampfdruck
52,60 atm bei 20 ° C. Beachten Sie, wie hoch der Dampfdruck ist, obwohl er weniger flüchtig ist als andere paraffinische Lösungsmittel wie Hexan und Pentan..
Dichte
0,6795 g / cm3. Andererseits sind Heptandämpfe 3,45-mal dichter als Luft, was bedeutet, dass ihre Dämpfe in Räumen verweilen, in denen ein wenig Flüssigkeit austritt..
Wasserlöslichkeit
Heptan ist eine hydrophobe Verbindung und kann sich kaum in Wasser lösen, um eine Lösung mit einer Konzentration von 0,0003% bei einer Temperatur von 20 ° C herzustellen..
Löslichkeit in anderen Lösungsmitteln
Heptan ist mit Tetrachlorkohlenstoff, Ethanol, Aceton, Leichtbenzin und Chloroform mischbar..
Brechungsindex (nD.)
1,3855.
Viskosität
0,389 mPa s
Wärmekapazität
224,64 J / K mol
Zündpunkt
-4 ºC
Selbstentzündungstemperatur
223 ºC
Oberflächenspannung
19,66 mN / m bei 25 ºC
Verbrennungswärme
4817 kJ / mol.
Reaktivität
Heptandämpfe reagieren in der Nähe einer Wärmequelle (einer Flamme) exotherm und heftig mit dem Luftsauerstoff:
C.7H.16 + 11Ozwei => 7COzwei + 8HzweiODER
Außerhalb der Verbrennungsreaktion ist Heptan jedoch eine ziemlich stabile Flüssigkeit. Seine mangelnde Reaktivität beruht auf der Tatsache, dass seine CH-Bindungen schwer aufzubrechen sind und daher nicht für Substitutionen anfällig sind. Ebenso ist es nicht sehr empfindlich gegenüber starken Oxidationsmitteln, solange kein Feuer in der Nähe ist..
Die größte Gefahr von Heptan besteht in seiner hohen Flüchtigkeit und Entflammbarkeit. Daher besteht Brandgefahr, wenn es an heißen Orten verschüttet wird.
Anwendungen
Lösungsmittel und Reaktionsmedium

Der hydrophobe Charakter von Heptan macht es zu einem hervorragenden Lösungsmittel zum Auflösen von Ölen und Fetten. In dieser Hinsicht wurde es als Entfetter verwendet. Seine größte Anwendung liegt jedoch in der Verwendung als Extraktionslösungsmittel, da es die Lipidkomponenten sowie die anderen organischen Verbindungen einer Probe löst..
Wenn Sie beispielsweise alle Bestandteile von gemahlenem Kaffee extrahieren möchten, wird dieser in Heptan anstelle von Wasser mazeriert. Diese Methode und ihre Variationen wurden bei allen Arten von Samen angewendet, dank derer Pflanzenessenzen und andere natürliche Produkte erhalten wurden..
Heptan, das von Natur aus farblos ist, färbt sich zur Farbe des extrahierten Öls. Dann wird es gedreht, um schließlich ein Volumen des Öls zu erhalten, das so rein wie möglich ist..
Andererseits ermöglicht die geringe Reaktivität von Heptan auch, dass es eine Option ist, wenn ein Reaktionsmedium zur Durchführung einer Synthese in Betracht gezogen wird. Als gutes Lösungsmittel für organische Verbindungen stellt es sicher, dass die Reagenzien in Lösung bleiben und während der Reaktion richtig miteinander interagieren.
Fällungsmittel
In der Erdölchemie ist es üblich, Asphaltene aus einer Rohprobe durch Zugabe von Heptan auszufällen. Diese Methode ermöglicht es, die Stabilität verschiedener Rohöle zu untersuchen und zu bestimmen, wie anfällig ihr Asphaltengehalt für Ausfällungen ist und eine ganze Reihe von Problemen für die Ölindustrie verursacht..
Oktan
Heptan wurde wegen der großen Wärmemenge, die es beim Verbrennen abgibt, als Brennstoff verwendet. Bei Automotoren wäre es jedoch nachteilig für ihre Leistung, wenn sie in reiner Form verwendet würden. Da es sehr explosionsartig brennt, dient es dazu, 0 auf der Benzinoktanskala zu definieren..
Benzin enthält einen hohen Prozentsatz an Heptan und anderen Kohlenwasserstoffen, um die Oktanzahl auf bekannte Werte (91, 95, 87, 89 usw.) zu bringen..
Verweise
- Morrison, R. T. und Boyd, R., N. (1987). Organische Chemie. 5. Auflage. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Graham Solomons T. W., Craig B. Fryhle. (2011). Organische Chemie. (10. Auflage). Wiley plus.
- Wikipedia. (2020). Heptan. Wiederhergestellt von: en.wikipedia.org
- Nationales Zentrum für Informationen zur Biotechnologie. (2020). Heptane PubChem-Datenbank. CID = 8900. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Elsevier B.V. (2020). Heptane ScienceDirect. Wiederhergestellt von: sciencedirect.com
- Bell Chem Corp. (7. September 2018). Industrielle Verwendung von Heptan. Wiederhergestellt von: bellchem.com
- Andrea Kropp. (2020). Heptan: Struktur, Verwendung & Formel. Studie. Wiederhergestellt von: study.com



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.