
Hämolysin Eigenschaften, Typen, Wirkmechanismen

Das Hämolysin Es ist ein kleines Protein, das Poren in der Zellmembran von Erythrozyten und einigen anderen Zellen des Säugetierbluts verursacht. Es wird im Allgemeinen von pathogenen Bakterien synthetisiert und ausgeschieden.
Dieses Protein ist eines der häufigsten mikrobiellen Toxine und das am besten untersuchte. Manchmal kann es zu einer hämolytischen Anämie kommen, da die Anzahl der Kanäle, durch die das Zellinnere austritt, sogar eine Zelllyse verursachen kann.
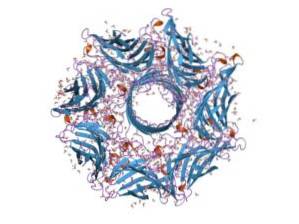
Im Allgemeinen ist Hämolysin ein typisches Toxin der Spezies von Streptococcus des Darmtraktes. Seine Funktion ermöglicht es Bakterien, die Epithelbarriere des Darmtrakts zu durchbrechen und sich so durch den Blutkreislauf zu bewegen, um andere Gewebe zu besiedeln..
Die häufigste Form, in der Hämolysin in der Natur vorkommt, ist die α-Hämolysinform. Dieses Protein ist einer der wichtigsten Virulenzfaktoren der meisten Stämme von Escherichia coli und einige Clostridien.
Die meisten Harnwegsinfektionen werden durch Stämme von verursacht Escherichia coli Herstellung von α-Hämolysin mit hämolytischen Eigenschaften.
Die Produktion von Hämolysin und Bakteriocin in Bakterienstämmen wurde mit einem Konkurrenzmechanismus gegen die anderen Spezies in Verbindung gebracht, und die Produktion beider Toxine scheint von denselben genetischen Determinanten im Genom der Bakterien abzuhängen..
Artikelverzeichnis
- 1 Funktionen
- 2 Arten
- 2,1 α-Hämolysin
- 2,2 & bgr; -Hämolysin
- 2,3 γ-Hämolysin
- 3 Wirkmechanismen
- 3.1 Membranbindung
- 3.2 Einbringen von Toxin in die Membran
- 3.3 Oligomerisierung
- 4 Referenzen
Eigenschaften
Hämolysin besteht aus sieben Untereinheiten und das Gen, das es codiert, hat sieben Promotoren. Diese sieben Untereinheiten setzen sich in die Plasmamembran der Zielzellen ein und bilden beim Zusammenkommen einen Ionenkanal, durch den Metaboliten aus dem Zellinneren entweichen..
Hämolysin ist ein extrazelluläres Calcium (Ca + 2) -abhängiges Zytotoxin, das auf die Plasmamembran von Blutkreislaufzellen wirkt. Die Poren, die es in der Membran erzeugt, sind ebenfalls hydrophil und führen dazu, dass Wasser in das Zellinnere eindringt, was zur Lyse führen kann..
Hämolysine sind typische Proteinprodukte von gramnegativen Bakterien und haben alle zwei Eigenschaften gemeinsam:
1- Das Vorhandensein eines sehr kleinen Peptids (Nonapeptids), das aus Wiederholungen der Aminosäuren Glycin und Asparaginsäure besteht. Die Nonapeptide von Hämolysin befinden sich in der Nähe des C-terminalen Teils der Primärstruktur des Proteins.
2- Alle Hämolysine werden von den Bakterien über einen ABC-Transporter (ATP-Bindungskassette) in die extrazelluläre Umgebung sekretiert..
Die Hämolysinproduktion wird normalerweise in Bakterienstämmen durch Wachstum auf Blutagarmedium nachgewiesen. Im Test wird ein hämolytischer Lichthof beobachtet, ein Produkt des Abbaus roter Blutkörperchen in der Nähe der Bakterienkolonien.
Typen
Es gibt verschiedene Arten von Hämolysinen, die am Anfang ihres Namens mit einem griechischen Buchstaben versehen sind. Die am häufigsten untersuchten und häufigsten sind α-, β- und γ-Hämolysine, die alle vom Stamm produziert werden Staphylococcus aureus.
Die Arten von Hämolysin werden nach dem Bereich der Zellen, die sie angreifen, und nach ihrer Primärstruktur des Proteins klassifiziert..
α-Hämolysin
Dieses Protein ist typisch für Stämme von Staphylococcus aureus Y. Escherichia coli;; befällt Neutrophile, rote Blutkörperchen, Lymphozyten, Makrophagen, adulte und embryonale Fibroblasten. Interagiert mit den Polköpfen der Plasmamembranlipide dieser Zellen, um einen hydrophoben Schwanz von etwa 5 Ӑ innerhalb der Membran zu internalisieren.
β-Hämolysin
Produziert von Staphylococcus aureus In geringerem Maße als α-Hämolysin greift β-Hämolysin hauptsächlich Erythrozyten an und gelangt ausschließlich über die sphingomyelinreichen Domänen der Zellmembran in die Membran.
γ-Hämolysin
Es wurde auch in beobachtet Staphylococcus aureus. Es wurde gleichzeitig als hämolytisches Protein und Leukotoxin klassifiziert, da es polymorphkernige Zellen von Menschen, Monozyten, Makrophagen und selten sogar rote Blutkörperchen betrifft.
Diese Art von γ-Hämolysin ist eine der am wenigsten charakterisierten, daher ist ein Großteil ihres Wirkungsmechanismus unbekannt und wurde nicht untersucht in vivo.
Aktionsmechanismen
Der Wirkungsmechanismus, der relativ klar aufgeklärt wurde, ist der von α-Hämolysin. Da es sich jedoch alle um hämolytische Proteine handelt, wird angenommen, dass die meisten Prozesse allen Hämolysinen gemeinsam sind..
Wissenschaftler schlagen vor, dass Bakterien, um Hämolysin in die Umwelt abzuscheiden, sich in einer nährstoffarmen Mikroumgebung befinden müssen. Daher wäre dies ein Mechanismus, der die Zelle dazu veranlasst, die Zielzellen zu zerstören und ihre Nährstoffe zu erhalten..
Der Mechanismus wurde in drei Schritten beschrieben: Zellmembranbindung, Insertion und Oligomerisierung..
Membranbindung
Es wurde gefunden, dass Hämolysine in der Lage sind, an neutrophile Integrine zu binden, und in Erythrozyten wurde gefunden, dass diese Proteine an glykosylierte Komponenten wie Glykoproteine, Ganglioside und Zellmembranglykophorine binden..
Einige Autoren schlagen vor, dass das Vorhandensein von Rezeptoren auf der Membran für die Bindung von Hämolysinen nicht wesentlich ist. In jedem Fall ist der Mechanismus der zellulären Wiederaufnahme des Proteins noch nicht genau bekannt..
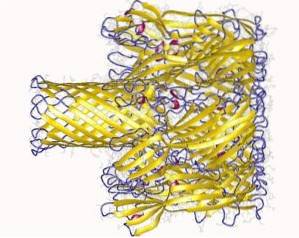
Die Wechselwirkung mit der Membran erfolgt in zwei Schritten:
- Anfängliche Bindung (reversibel): Wenn Hämolysin an die Calcium-Bindungsdomänen der Membran bindet. Dieser Schritt tritt an der Oberfläche auf und ist sehr anfällig für elektrostatische Entladung..
- Irreversible Bindung: Verbindet die Aminosäuredomänen mit den Lipidkomponenten der äußeren Schicht der Plasmamembran der Zielzellen, um physikalische Bindungen zwischen den hydrophoben Verbindungen der Membran zu bilden.
Einbringen von Toxin in die Membran
Α-Hämolysin fügt die Reste 177 und 411 in die erste Lipidmonoschicht ein. In der extrazellulären Umgebung ist Hämolysin mit Calciumionen assoziiert, die eine strukturelle Anordnung in ihm induzieren und zu seiner Aktivierung beitragen..
Diese Insertion konsolidiert die irreversible Anhaftung an die Zellmembran. Sobald die Anordnung erfolgt ist, wird Hämolysin ein integrales Protein, da experimentell gezeigt wurde, dass der einzige Weg, es aus der Membran zu extrahieren, die Verwendung von Detergenzien wie Triton X-100 ist.
Oligomerisierung
Wenn das gesamte Hämolysin in die Plasmamembran der Zielzellen eingefügt wurde, findet die Oligomerisierung der 7 Untereinheiten statt, aus denen es besteht, was zur Bildung einer Proteinpore führt, die sehr dynamisch ist, jedoch von der Lipidzusammensetzung der Membran abhängt ..
Es wurde beobachtet, dass der Oligomerisierungsprozess durch die Mikrodomänen oder Lipidflöße der Zellmembran begünstigt wird. Diese Regionen begünstigen möglicherweise nicht die Bindung des Proteins, aber sie begünstigen dessen Oligomerisierung, sobald es inseriert ist..
Je mehr Hämolysine an die Membran binden, desto mehr Poren bilden sich. Darüber hinaus können sich Hämolysine gegenseitig (benachbarte) oligomerisieren und viel größere Kanäle bilden..
Verweise
- L. Bakás, H. Ostolaza, W. L. Vaz & F. M. Goñi (1996). Reversible Adsorption und nichtreversible Insertion von Escherichia coli alpha-Hämolysin in Lipiddoppelschichten. Biophysical Journal, 71 (4), 1869–1876.
- M. Dalla Serra, M. Coraiola, G. Viero, M. Comai, C. Potrich, M. Ferreras,… & G. Prévost (2005). Staphylococcus aureus-Zweikomponenten-γ-Hämolysine, HlgA, HlgB und HlgC, können gemischte Poren bilden, die alle Komponenten enthalten. Journal of Chemical Information and Modeling, 45 (6), 1539-1545.
- J. A. Gow & J. Robinson (1969). Eigenschaften von gereinigtem Staphylokokken-β-Hämolysin. Journal of Bacteriology, 97 (3), 1026 & ndash; 1032.
- Y. Ike, H. Hashimoto & D. B. Clewell (1984). Hämolysin der Streptococcus faecalis-Unterart zymogenes trägt zur Virulenz bei Mäusen bei. Infektion und Immunität, 45 (2), 528-530.
- J. S. Remington, J. O. Klein, C. B. Wilson, V. Nizet & Y. A. Maldonado (Hrsg.). (1976). Infektionskrankheiten des Fötus und des Neugeborenen (Band 4). Philadelphia: Saunders.
- Todd, E. W. (1932). Antigenes Streptokokken-Hämolysin. Journal of Experimental Medicine, 55 (2), 267 & ndash; 280.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.