
Alkylhalogenideigenschaften, Herstellung, Beispiele

Das Alkylhalogenide sind organische Verbindungen, in denen ein Kohlenstoffatom mit sp-Hybridisierung vorliegt3 ist kovalent an ein Halogen gebunden (F, Cl, Br, I). Aus einer anderen Perspektive ist es zweckmäßig, zu vereinfachen und anzunehmen, dass es sich um Halogenalkane handelt; Dies sind Alkane, bei denen einige H-Atome durch Halogenatome ersetzt wurden.
Wie der Name schon sagt, müssen Halogenatome an Alkylgruppen R gebunden sein, um von dieser Art von Halogenid in Betracht gezogen zu werden. strukturell können sie jedoch substituiert oder verzweigt sein und aromatische Ringe aufweisen und bleiben dennoch ein Alkylhalogenid.
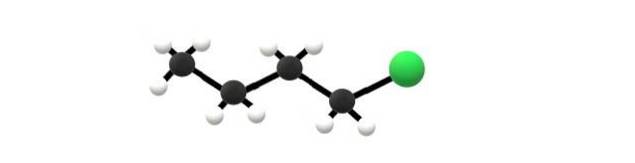
Oben ist das 1-Chlorbutanmolekül dargestellt, das einem der einfachsten Alkylhalogenide entspricht. Es ist ersichtlich, dass alle seine Kohlenstoffe Einfachbindungen und auch eine sp-Hybridisierung aufweisen3. Daher ist die grüne Kugel, die dem Cl-Atom entspricht, mit einem von Alkanbutan abgeleiteten Gerüst verbunden.
Noch einfachere Beispiele als 1-Chlorbutan sind solche, die aus Methangas gewonnen werden: der kleinste Kohlenwasserstoff von allen.
Aus seinem Molekül CH4 H-Atome können beispielsweise durch Jod ersetzt werden. Wenn ein H ersetzt wird, haben wir das CH3I (Iodmethan oder Methyliodid). Durch Ersetzen von zwei H erhalten wir den CHzweiichzwei (Diiodmethan oder Methyleniodid). Dann und schließlich ersetzen die Ichs alle Hs durch CHI3 (Iodoform) und CI4 (Tetraiodkohlenstoff).
Alkylhalogenide zeichnen sich dadurch aus, dass sie sehr reaktiv sind, und da sie die elektronegativsten Atome im Periodensystem aufweisen, wird angenommen, dass sie durch endlose Mechanismen einen Einfluss auf biologische Matrizen ausüben.
Artikelverzeichnis
- 1 Eigenschaften von Alkylhalogeniden
- 1.1 Siede- und Schmelzpunkte
- 1.2 Polarität
- 1.3 Lösungsmittelkraft
- 2 Nomenklatur
- 2.1 Beispiel
- 3 Erhalten
- 3.1 Halogenierung mit Licht oder ultravioletter Strahlung
- 3.2 Zugabe von Hydrociden oder Halogenen zu Alkenen
- 4 Reaktionen
- 4.1 Nucleophile Substitution
- 4.2 Entsorgung
- 4.3 Synthese von Grignard-Reagenzien
- 5 Beispiele
- 6 Verwendungen
- 6.1 Lösungsmittel
- 6.2 Organische Synthese
- 6.3 Pharmazeutische Industrie
- 6.4 Kältemittel
- 7 Referenzen
Eigenschaften von Alkylhalogeniden
Die Eigenschaften dieser Verbindungsfamilie hängen von ihren Molekülstrukturen ab. Im Vergleich zu den abgeleiteten Alkanen können jedoch bemerkenswerte Unterschiede beobachtet werden, die durch die einfache Tatsache verursacht werden, dass C-X-Bindungen vorliegen (X = Halogenatom)..
Das heißt, die C-X-Bindungen sind für jeden Unterschied oder jede Ähnlichkeit zwischen einem oder mehreren Alkylhalogeniden verantwortlich..
Zunächst sind die CH-Bindungen angesichts des geringen Elektronegativitätsunterschieds zwischen C und H nahezu unpolar; Andererseits weisen die C-X-Bindungen ein permanentes Dipolmoment auf, da Halogene elektronegativer sind als Kohlenstoff (insbesondere Fluor)..
Andererseits sind einige Halogene leicht (F und Cl), während andere schwer sind (Br und I). Ihre Atommassen formen auch Unterschiede innerhalb der C-X-Bindungen; und wiederum direkt auf die Eigenschaften des Halogenids.
Daher ist die Zugabe von Halogenen zu einem Kohlenwasserstoff gleichbedeutend mit der Erhöhung seiner Polarität und Molekülmasse; Dies bedeutet, dass es weniger flüchtig (bis zu einem gewissen Punkt) und weniger brennbar ist und seine Siede- oder Schmelzpunkte erhöht.
Siede- und Schmelzpunkte
Nachstehend sind die Größe und damit das Gewicht der verschiedenen Halogene in aufsteigender Reihenfolge angegeben:
F. < Cl < Br < I
Daher kann erwartet werden, dass Alkylhalogenide, die F-Atome enthalten, leichter sind als solche, die Br- oder I-Atome enthalten..
Beispielsweise werden einige von Methan abgeleitete Halogenide betrachtet:
CH3F. < CH3Cl < CH3Br < CH3ich
CHzweiF.zwei < CHzweiClzwei < CHzweiBrzwei < CHzweiichzwei
Und so weiter für das andere Derivatprodukt mit einem höheren Halogenierungsgrad. Beachten Sie, dass die Reihenfolge beibehalten wird: Fluorhalogenide sind leichter als Jodhalogenide. Nicht nur das, sondern auch ihre Siede- und Schmelzpunkte gehorchen dieser Reihenfolge; RF siedet bei niedrigeren Temperaturen als RI (R = CH3, für diesen Fall).
Ebenso sind alle diese Flüssigkeiten farblos, da Elektronen in ihren C-X-Bindungen keine Photonen absorbieren oder freisetzen können, um andere Energieniveaus zu durchlaufen. Wenn sie jedoch schwerer werden, können sie kristallisieren und Farben anzeigen (ebenso wie Iodoform, CHI3).
Polarität
C-X-Bindungen unterscheiden sich in der Polarität, jedoch in umgekehrter Reihenfolge wie oben:
C-F> C-Cl> C-Br> C-I
Daher sind CF-Bindungen polarer als C-I-Bindungen. RF-Halogenide sind polarer und neigen dazu, durch Dipol-Dipol-Kräfte zu interagieren. Währenddessen sind in RBr- oder RI-Halogeniden ihre Dipolmomente schwächer und die Wechselwirkungen, die von den Londoner Dispersionskräften gesteuert werden, gewinnen an Stärke..
Lösungsmittelkraft
Da die Alkylhalogenide polarer sind als die Alkane, von denen sie abgeleitet sind, erhöhen sie ihre Fähigkeit, eine größere Anzahl organischer Verbindungen aufzulösen. Aus diesem Grund neigen sie dazu, bessere Lösungsmittel zu sein; Dies bedeutet jedoch nicht, dass sie Alkane in allen Anwendungen ersetzen können.
Es gibt technische, ökonomische, ökologische und Leistungskriterien, um ein halogeniertes Lösungsmittel einem Alkan vorzuziehen.
Nomenklatur
Es gibt zwei Möglichkeiten, ein Alkylhalogenid zu benennen: nach seinem gebräuchlichen Namen oder nach seinem systematischen Namen (IUPAC). Allgemeine Namen sind normalerweise bequemer zu verwenden, wenn RX einfach ist:
CHCl3
Chloroform: gebräuchlicher Name
Methyltrichlorid oder Trichlormethan: IUPAC-Name.
Systematische Namen sind jedoch vorzuziehen (und die einzige Option), wenn Sie verzweigte Strukturen haben. Ironischerweise sind gebräuchliche Namen wieder nützlich, wenn die Strukturen zu kompliziert sind (wie die, die im letzten Abschnitt zu sehen sein werden)..
Die Regeln für die Benennung einer Verbindung nach dem IUPAC-System sind dieselben wie für Alkohole: Die Hauptkette wird identifiziert, die am längsten oder am verzweigtsten ist. Dann werden die Kohlenstoffe beginnend an dem Ende aufgelistet, das den Substituenten oder Zweigen am nächsten liegt, und zwar in alphabetischer Reihenfolge.
Beispiel
Um dies zu veranschaulichen, haben wir das folgende Beispiel:
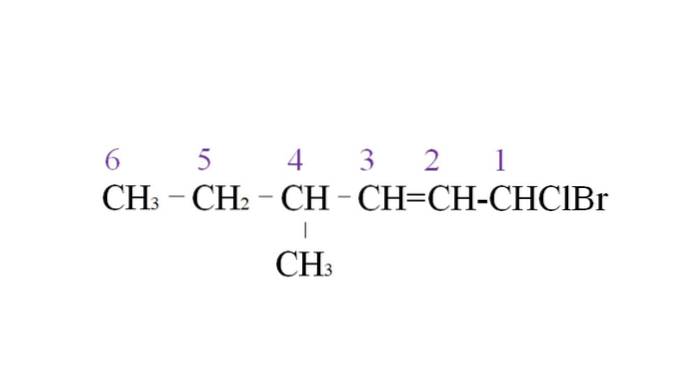
Der erste Zweig ist die Methylgruppe an C-4; Da es sich jedoch um eine Doppelbindung handelt, hat diese eine höhere Priorität als die angegebene Regel. Aus diesem Grund wird die längste Kette von rechts aufgelistet, angeführt von einem Kohlenstoffatom, das an zwei Halogene gebunden ist: Cl und Br.
Bei der Aufzählung werden die Substituenten in alphabetischer Reihenfolge benannt:
1-Brom-1-chlor-4-methyl-2-hexen.
Erhalten
Um die Alkylhalogenide zu erhalten, müssen die Moleküle einem Halogenierungsprozess unterzogen werden; das heißt, Halogenatome in ihre Strukturen einbauen, insbesondere ein Atom mit einem Kohlenstoff sp3.
Es gibt zwei Methoden, um sie zu erhalten oder zu synthetisieren: durch ultraviolette Strahlung durch einen Radikalmechanismus oder durch Zugabe von Hydrociden oder Halogenen..
Halogenierung mit Licht oder ultravioletter Strahlung
Die erste, die am wenigsten geeignete und mit der schlechtesten Leistung besteht darin, die Alkane mit ultravioletter Strahlung zu bestrahlen (hv) in Gegenwart eines Halogens. Zum Beispiel sind die Gleichungen für die Chlorierung von Methan gezeigt:
CH4 + Clzwei => CH3Cl + HCl (unter UV-Licht)
CH3Cl + Clzwei => CHzweiClzwei + HCl
CHzweiClzwei + Clzwei => CHCl3 + HCl
CHCl3 + Clzwei => CCl4 + HCl
Die vier Verbindungen (CH3Cl, CHzweiClzwei, CHCl3 und CCl4) gebildet werden, und daher haben Sie eine Mischung, die einer fraktionierten Destillation unterzogen werden kann. Dieses Verfahren ist jedoch unpraktisch und der Rückgriff auf organische Synthesen ist bevorzugt..
Ein weiteres Beispiel ist die Bromierung von n-Hexan:
CH3CHzweiCHzweiCHzweiCHzweiCH3 + Brzwei => CH3(Br) CHCHzweiCHzweiCHzweiCH3 + HBr
Auch bei dieser Reaktion wird Licht oder ultraviolette Strahlung verwendet, um die Bildung freier Radikale zu fördern. Brom, da es eine tiefrote Flüssigkeit ist, verfärbt sich bei seiner Reaktion und beobachtet so einen Farbwechsel von rot zu farblos, wenn 2-Bromhexan gebildet wird..
Zugabe von Hydrociden oder Halogenen zu Alkenen
Das zweite Verfahren zur Gewinnung von Alkylhalogeniden besteht in der Behandlung von Alkoholen (ROH) oder Alkenen (R.zweiC = CRzwei) mit Hydraciden. Hydracide haben die allgemeine Formel HX (HF, HCl, HBr und HI). Für jeden von ihnen wird ein Beispiel mit Ethanol gezeigt:
CH3CHzweiOH + HF => CH3CHzweiF + H.zweiODER
CH3CHzweiOH + HCl => CH3CHzweiCl + H.zweiODER
CH3CHzweiOH + HBr => CH3CHzweiBr + H.zweiODER
CH3CHzweiOH + HI => CH3CHzweiI + H.zweiODER
Ebenso können Alkene HX-Moleküle zu ihren Doppelbindungen hinzufügen und sekundäre Alkylhalogenide bilden..
CHzwei= CH-CH3 + HBr => BrCHzwei-CHzwei-CH3 + CH3-CHBr-CH3
Das BrCH-Produktzwei-CHzwei-CH3 ist 1-Brompropan und CH3-CHBr-CH3 2-Brompropan. Das zweite ist das Hauptprodukt, weil es am stabilsten ist, während das erste in geringerem Maße hergestellt wird, weil es instabiler ist. Dies liegt daran, dass der CH3CHBrCH3 ist ein sekundäres Alkylhalogenid.
Sehr ähnlich tritt auf, wenn dem Alken ein Molekül von X zugesetzt wirdzwei::
CHzwei= CH-CH3 + Brzwei => BrCHzwei-CHBr-CH3
Es wird jedoch ein Alkylhalogenid mit zwei Bromatomen erhalten, die an benachbarte Kohlenstoffe gebunden sind; vicinales Alkylhalogenid. Wenn Sie andererseits die beiden Brome an denselben Kohlenstoff gebunden hätten, hätten Sie ein geminales Alkylhalogenid wie das folgende:
BrzweiCH-CHzwei-CH3
Reaktionen
Nucleophile Substitution
Die Reaktivitäten von Alkylhalogeniden basieren auf der Sprödigkeit oder Stärke der C-X-Bindung. Je schwerer das Halogen ist, desto schwächer ist die Bindung und desto leichter bricht sie. Bei einer chemischen Reaktion werden Bindungen aufgebrochen und neue gebildet; C-X-Bindungen werden gebrochen, um eine C-G-Bindung zu bilden (G = neue Gruppe).
In geeigneteren Begriffen fungiert X als austretende Gruppe und G als eintretende Gruppe in einer Reaktion von nukleophile Substitution. Warum tritt diese Reaktion auf? Weil X elektronegativer als Kohlenstoff ist, "stiehlt" es die Elektronendichte und hinterlässt ein Elektronendefizit, das sich in einer positiven Teilladung niederschlägt:
C.δ+-X.δ-
Wenn eine negative Art (: G.-) oder neutral mit einem verfügbaren Elektronenpaar (: G), das eine stabilere C-G-Bindung bilden kann, wird X durch G ersetzt. Das Obige kann durch die folgende chemische Gleichung dargestellt werden:
RX +: G.- => RG + X.-
Je schwächer die C-X- oder R-X-Bindung ist, desto größer ist ihre Reaktivität oder Tendenz, durch die ersetzt zu werden nukleophiles Mittel (oder Nucleophil) G; das heißt, Liebhaber von Kernen oder positiven Ladungen.
Beispiele
Eine Reihe allgemeiner Gleichungen für die nukleophilen Substitutionen, die Alkylhalogenide eingehen können, ist nachstehend gezeigt:
RX + OH- => ROH + X.- (Alkohole)
+ ODER'- => ROR' (Ether, Williamson-Synthese)
+ ich- => RI (Alkyliodide)
+ CN- => RCN (Nitrile)
+ R'COO- => RCOOR '(Ester)
+ NH3 => RNHzwei (Amine)
+ P (C.6H.5)3 => RP (C.6H.5)3+ X.- (Phosphoniumsalze)
+ Sch- => RSH (Thiole)
Aus diesen Beispielen kann bereits vermutet werden, wie wertvoll Alkylhalogenide für organische Synthesen sind. Eine der vielen noch zu zitierenden Substitutionen ist die der Friedel-Crafts-Reaktion, mit der aromatische Ringe "gemietet" werden:
RX + ArH + AlCl3 => ArR
Bei dieser Reaktion wird ein H des aromatischen Rings durch eine R-Gruppe aus dem RX ersetzt.
Beseitigung
Alkylhalogenide können HX-Moleküle durch eine Eliminierungsreaktion freisetzen; speziell eine Dehydrohalogenierung:
R.zweiCH-CXRzwei + Oh- => R.zweiC = CRzwei + HX
Es wird gesagt, dass eine Dehydrohalogenierung auftritt, weil sowohl ein H als auch ein X in demselben HX-Molekül verloren gehen.
Synthese von Grignard-Reagenzien
Alkylhalogenide können mit bestimmten Metallen unter Bildung des Grignard-Reagens reagieren, das zur Addition von R-Gruppen an andere Moleküle verwendet wird. Die allgemeine Gleichung für seine Synthese lautet wie folgt:
RX + Mg => RMgX
Beispiele
In den Abschnitten wurden bereits verschiedene Beispiele für Alkylhalogenide erwähnt. Einige andere, einfach, sind:
-Ethylchlorid, CH3CHzweiCl
-Isopropylfluorid (CH3)zweiCHzweiF.
-2-Methyl-3-chlorpentan, CH3-CH (CH3) -CHCl-CHzweiCH3
-sec-Butyliodid, CH3CHzweiCHzweiI-CH3
-3-Brom-6-iodheptan, CH3-CHzwei-CHBr-CHzwei-CHzwei-CHzweiich
-3,4-Dibrom-1-penten, CH3-CHBr-CHBr-CH = CHzwei
Anwendungen
Lösungsmittel
In früheren Abschnitten wurde die Lösungsmittelkapazität der Alkylhalogenide erwähnt. Die Industrie hat diese Eigenschaft genutzt, um sie als Reinigungsmittel für Textilmaterialien, elektronische Komponenten oder zur Entfernung von Lackflecken zu verwenden..
Ebenso werden sie als Lösungsmittel für Farben oder als organische oder fettige Proben für unzählige Arten von analytischen Tests verwendet..
Organische Synthese
Alkylhalogenide sind sehr nützlich für die "Alkylierung" aromatischer Ringe und dienen als Ausgangsquelle für die Synthese praktisch aller anderen Familien organischer Verbindungen. Synthetisch wird RX als Quelle für R-Gruppen oder -Ketten angesehen, die für den Einbau in hocharomatische Verbindungen erwünscht sein können..
Pharmaindustrie
Zu Beginn wurde erwähnt, dass Halogenatome mit biologischen Matrices interagieren, so dass sie in unseren Organismen nicht unbemerkt bleiben können, ohne eine positive oder negative Veränderung hervorzurufen. Wenn ein Medikament eine positive Wirkung auf den Körper ausübt und ein Halogenatom aufweist, kann diese Wirkung verstärkt sein oder nicht.
Wenn also X direkt an einen sp-hybridisierten Kohlenstoff gebunden ist3, es wird ein Alkylhalogenid und kein halogeniertes Derivat haben. Einige solcher Halogenide sind nachstehend in der folgenden Bildserie gezeigt:
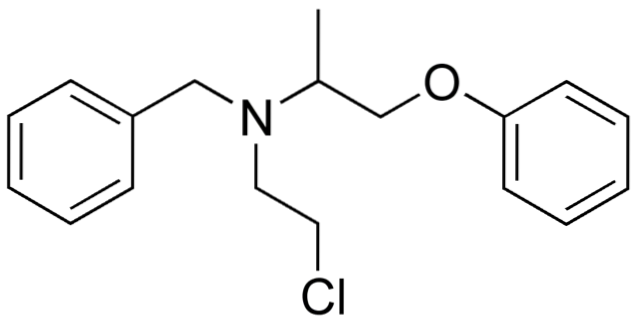
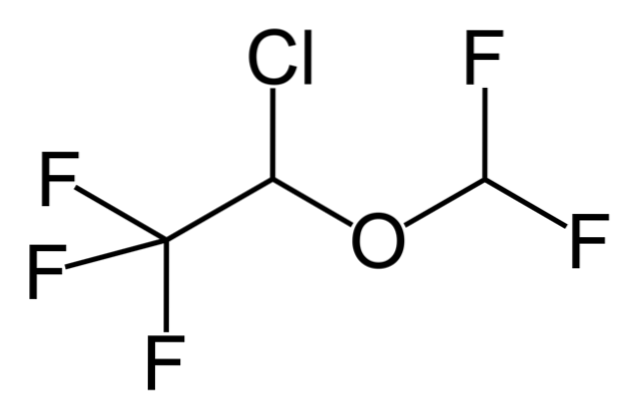

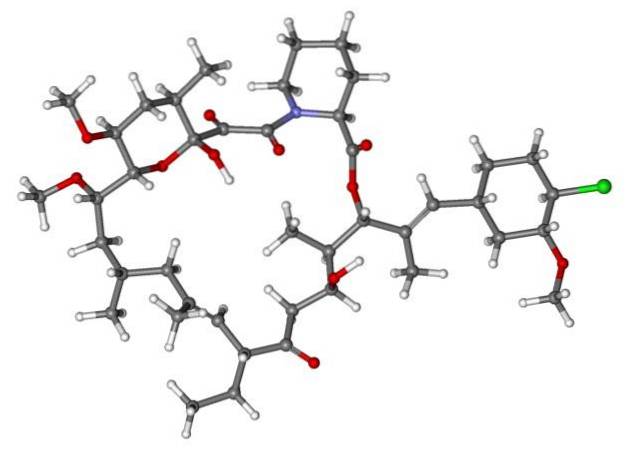

Es ist zu beachten, dass in diesen fünf Arzneimitteln mindestens eine Bindung vom CH-Typ vorhanden istzwei-X oder CH-X; das heißt, das Halogen ist an einen sp-Kohlenstoff gebunden3.
Kältemittel
Das berühmte Kältemittel Freon-12 (CHCIFzwei) ersetzten wie andere Fluoralkane oder Fluorkohlenwasserstoffe in dieser Funktion Ammoniakgase und Fluorchlorkohlenwasserstoffe (FCKW), da sie, obwohl sie nichtflüchtige oder toxische Substanzen sind, die Ozonschicht zerstören; während Freon-12, das reaktiver ist, zerstört wird, bevor solche Höhen erreicht werden.
Verweise
- Carey F. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Clark Jim. (2016, 14. Juli). Verwendung von Alkylhalogeniden. Chemie LibreTexts. Wiederhergestellt von: chem.libretexts.org
- B. Gál, C. Bucher & N. Z. Burns (2016). Chirale Alkylhalogenide: Unerforschte Motive in der Medizin. Marine Drugs, 14 (11), 206. doi: 10.3390 / md14110206
- Alkylhalogenide. Wiederhergestellt von: chemed.chem.purdue.edu
- Patkar Prachi. (16. Juli 2017). Alles über Alkylhalogenide: Eigenschaften, Verwendung und vieles mehr. Wissenschaft getroffen. Wiederhergestellt von: sciencestruck.com
- R. Schiff. (2016). Alkylhalogenide. Wiederhergestellt von: hyperphysics.phy-astr.gsu.edu
- Lernhandbuch für Kapitel 9 - Alkylhalogenide I. Wiederhergestellt von: cactus.dixie.edu
- Q.A. Eduardo Vega Barrios. (s.f.). Alkylhalogenide: Eigenschaften, Verwendungen und Anwendungen. [PDF. Wiederhergestellt von: cvonline.uaeh.edu.mx


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.