
Link Pi Wie es gebildet wird, Eigenschaften und Beispiele
EIN pi link (π) ist eine Art kovalenter Bindung, die unter anderem dadurch gekennzeichnet ist, dass sie die freie Rotationsbewegung von Atomen verhindert und zwischen zwei reinen Atomorbitalen vom reinen Typ entsteht. Es gibt Bindungen, die durch ihre Elektronen zwischen Atomen gebildet werden können, wodurch sie größere und komplexere Strukturen aufbauen können: Moleküle.
Diese Bindungen können von unterschiedlicher Art sein, aber die in diesem Untersuchungsbereich am häufigsten vorkommenden sind die Kovalenten. Kovalente Bindungen, auch molekulare Bindungen genannt, sind eine Art von Bindung, bei der die beteiligten Atome Elektronenpaare teilen.
Dies kann aufgrund der Notwendigkeit der Atome auftreten, nach Stabilität zu suchen, wodurch die meisten bekannten Verbindungen gebildet werden. In diesem Sinne können kovalente Bindungen einfach, doppelt oder dreifach sein, abhängig von der Konfiguration ihrer Orbitale und der Anzahl der Elektronenpaare, die zwischen den beteiligten Atomen geteilt werden..
Aus diesem Grund gibt es zwei Arten von kovalenten Bindungen, die aufgrund der Ausrichtung ihrer Orbitale zwischen Atomen gebildet werden: Sigma (σ) -Bindungen und pi (π) -Bindungen..
Es ist wichtig, beide Bindungen zu unterscheiden, da die Sigma-Bindung in einfachen Bindungen und pi in Mehrfachbindungen zwischen Atomen auftritt (zwei oder mehr Elektronen werden geteilt)..
Artikelverzeichnis
- 1 Wie entsteht es??
- 1.1 Bildung von Pi-Bindungen in verschiedenen chemischen Spezies
- 2 Funktionen
- 3 Beispiele
- 4 Referenzen
Wie ist es gebildet?
Um die Bildung der pi-Bindung zu beschreiben, muss zunächst der Hybridisierungsprozess diskutiert werden, da er in einige wichtige Bindungen eingreift..
Hybridisierung ist ein Prozess, bei dem hybride elektronische Orbitale gebildet werden. das heißt, wo sich s- und p-atomare Subebenen-Suborbitale vermischen können. Dies führt zur Bildung von sp, sp-Orbitalenzwei und sp3, die Hybriden genannt werden.
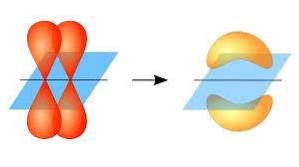
In diesem Sinne erfolgt die Bildung von pi-Bindungen dank der Überlappung eines Lappenpaares, das zu einem Atomorbital gehört, mit einem anderen Lappenpaar, das sich in einem Orbital befindet, das Teil eines anderen Atoms ist..
Diese Orbitalüberlappung tritt seitlich auf, wobei sich die elektronische Verteilung meist über und unter der Ebene konzentriert, die von den gebundenen Atomkernen gebildet wird, und bewirkt, dass die pi-Bindungen schwächer sind als die Sigma-Bindungen..
Wenn über die Orbitalsymmetrie dieser Art von Vereinigung gesprochen wird, sollte erwähnt werden, dass sie gleich der der Orbitale vom p-Typ ist, solange sie durch die durch die Bindung gebildete Achse beobachtet wird. Darüber hinaus bestehen diese Gewerkschaften hauptsächlich aus p-Orbitalen..
Bildung von Pi-Bindungen in verschiedenen chemischen Spezies
Da pi-Bindungen immer von einer oder zwei weiteren Bindungen (einem Sigma oder einem anderen pi und einem Sigma) begleitet werden, ist es wichtig zu wissen, dass die Doppelbindung zwischen zwei Kohlenstoffatomen (bestehend aus einem Sigma und einer pi-Bindung) gebildet wird. hat eine niedrigere Bindungsenergie als die, die der doppelten Sigma-Bindung zwischen den beiden entspricht.
Dies erklärt sich aus der Stabilität der Sigma-Bindung, die größer ist als die der Pi-Bindung, da die Überlappung der Atomorbitale in letzterer in den Regionen oberhalb und unterhalb der Lappen parallel auftritt und die elektronische Verteilung stärker akkumuliert entfernter Weg von Atomkernen.
Trotzdem wird bei Kombination von Pi- und Sigma-Bindungen eine stärkere Mehrfachbindung gebildet als die Einfachbindung selbst, was durch Beobachtung der Bindungslängen zwischen verschiedenen Einfach- und Mehrfachbindungsatomen überprüft werden kann..
Es gibt einige chemische Spezies, die auf ihr außergewöhnliches Verhalten untersucht werden, wie beispielsweise Koordinationsverbindungen mit metallischen Elementen, bei denen die Zentralatome nur durch pi-Bindungen verbunden sind..
Eigenschaften
Die Eigenschaften, die pi-Bindungen von anderen Arten von Wechselwirkungen zwischen Atomspezies unterscheiden, werden nachstehend beschrieben, beginnend mit der Tatsache, dass diese Bindung keine freie Rotationsbewegung von Atomen wie Kohlenstoff zulässt. Aus diesem Grund bricht die Bindung bei Rotation der Atome..
Ebenso tritt bei diesen Verbindungen die Überlappung zwischen den Orbitalen durch zwei parallele Regionen auf, wodurch erreicht wird, dass sie eine größere Diffusion als die Sigma-Verbindungen aufweisen und aus diesem Grund schwächer sind..
Andererseits wird, wie oben erwähnt, die pi-Bindung immer zwischen einem Paar reiner Atomorbitale erzeugt; Dies bedeutet, dass es zwischen Orbitalen erzeugt wird, die keinen Hybridisierungsprozessen unterzogen wurden, bei denen die Dichte der Elektronen hauptsächlich über und unter der durch die kovalente Bindung gebildeten Ebene konzentriert ist..
In diesem Sinne kann es zwischen einem Atompaar mehr als eine pi-Bindung geben, die immer von einer Sigma-Bindung begleitet wird (in den Doppelbindungen)..
In ähnlicher Weise kann es eine Dreifachbindung zwischen zwei benachbarten Atomen geben, die durch zwei Pi-Bindungen in Positionen, die Ebenen senkrecht zueinander bilden, und eine Sigma-Bindung zwischen beiden Atomen gebildet wird..
Beispiele
Wie bereits erwähnt, haben Moleküle, die aus Atomen bestehen, die durch eine oder mehrere pi-Bindungen verbunden sind, immer mehrere Bindungen. d.h. Doppel- oder Dreifach.
Ein Beispiel hierfür ist das Ethylenmolekül (H.zweiC = CHzwei), die aus einer Doppelbindung besteht; das heißt, eine pi und eine Sigma-Bindung zwischen ihren Kohlenstoffatomen zusätzlich zu den Sigma-Bindungen zwischen den Kohlenstoffen und Wasserstoffatomen.
Das Acetylenmolekül (H-C≡C-H) hat seinerseits eine Dreifachbindung zwischen seinen Kohlenstoffatomen; das heißt, zwei pi-Bindungen, die senkrechte Ebenen bilden, und eine Sigma-Bindung zusätzlich zu ihren entsprechenden Kohlenstoff-Wasserstoff-Sigma-Bindungen.
Pi-Bindungen treten auch zwischen cyclischen Molekülen wie Benzol (C) auf6H.6) und seine Derivate, deren Anordnung zu einem als Resonanz bezeichneten Effekt führt, der es der Elektronendichte ermöglicht, zwischen Atomen zu wandern und der Verbindung unter anderem eine größere Stabilität zu verleihen..
Um die zuvor erwähnten Ausnahmen zu veranschaulichen, die Fälle des Dicarbon-Moleküls (C = C, in dem beide Atome ein Paar gepaarter Elektronen haben) und der Koordinationsverbindung namens Hexacarbonyl-Eisen (dargestellt als Fe)zwei(CO)6, welches nur durch pi-Bindungen zwischen seinen Atomen gebildet wird).
Verweise
- Wikipedia. (s.f.). Pi-Bindung. Von en.wikipedia.org wiederhergestellt
- Chang, R. (2007). Chemie, 9. Auflage. Mexiko: McGraw-Hill.
- ThoughtCo. (s.f.). Pi-Bindungsdefinition in der Chemie. Von gedankenco.com wiederhergestellt
- Britannica, E. (s.f.). Pi-Bindung. Von britannica.com abgerufen
- LibreTexts. (s.f.). Sigma- und Pi-Anleihen. Von chem.libretexts.org wiederhergestellt
- Srivastava, A. K. (2008). Organische Chemie leicht gemacht. Von books.google.co.ve wiederhergestellt



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.