
Eigenschaften, Eigenschaften, Nomenklatur, Reaktivität der Carbonylgruppen
Das Carbonylgruppe Es ist eine organische und sauerstoffhaltige funktionelle Gruppe, die dem gasförmigen Kohlenmonoxidmolekül ähnelt. Es wird als C = O dargestellt und obwohl es als organisch angesehen wird, kann es auch in anorganischen Verbindungen gefunden werden; als Kohlensäure H.zweiCO3, oder in metallorganischen Verbindungen mit CO als Bindemittel.
In der Chemie des Kohlenstoffs, des Lebens, der Biochemie und anderen ähnlichen wissenschaftlichen Zweigen zeichnet sich diese Gruppe jedoch durch ihre enorme Bedeutung aus. Ohne ihn könnten viele Moleküle nicht mit Wasser interagieren. Proteine, Zucker, Aminosäuren, Fette, Nukleinsäuren und andere Biomoleküle würden ohne ihn nicht existieren.
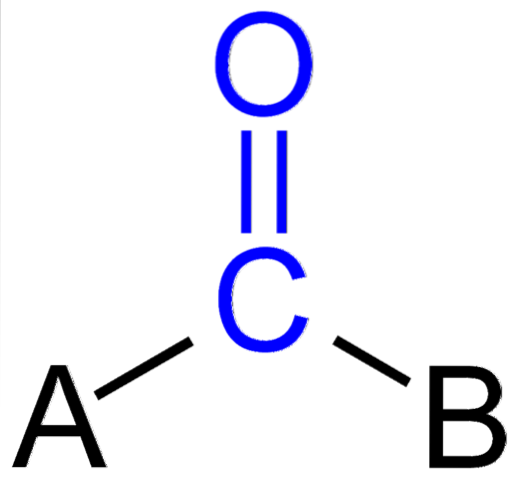
Das Bild oben zeigt, wie diese Gruppe im allgemeinen Skelett einer Verbindung aussieht. Es ist zu beachten, dass es durch die blaue Farbe hervorgehoben wird, und wenn wir die Substituenten A und B (R oder R ', gleichermaßen gültig) entfernen, würde ein Kohlenmonoxidmolekül verbleiben. Das Vorhandensein dieser Substituenten definiert eine große Anzahl organischer Moleküle.
Wenn A und B andere Atome als Kohlenstoff sind, wie Metalle oder nichtmetallische Elemente, kann man metallorganische bzw. anorganische Verbindungen aufweisen. Bei der organischen Chemie sind die Substituenten A und B immer entweder Wasserstoffatome, Kohlenstoffketten, Linien mit oder ohne Verzweigungen, cyclische oder aromatische Ringe..
Auf diese Weise beginnt es zu verstehen, warum die Carbonylgruppe für diejenigen, die Natur- oder Gesundheitswissenschaften studieren, durchaus üblich ist. es ist überall und ohne es würden die molekularen Mechanismen, die in unseren Zellen auftreten, nicht auftreten.
Wenn seine Relevanz zusammengefasst werden könnte, würde man sagen, dass es Polarität, Säure und Reaktivität zu einem Molekül beiträgt. Wenn es eine Carbonylgruppe gibt, ist es mehr als wahrscheinlich, dass das Molekül genau zu diesem Zeitpunkt eine Transformation durchlaufen kann. Daher ist es ein strategischer Ort, um die organische Synthese durch Oxidation oder nukleophile Angriffe zu entwickeln..
Artikelverzeichnis
- 1 Eigenschaften und Eigenschaften der Carbonylgruppe
- 1.1 Resonanzstrukturen
- 2 Nomenklatur
- 3 Reaktivität
- 3.1 Nucleophiler Angriff
- 3.2 Reduzierung
- 3.3 Bildung von Acetalen und Ketalen
- 4 Typen
- 5 Wie man es in Aldehyden und Ketonen identifiziert
- 5.1 Identifizierung
- 6 Hauptbeispiele
- 7 Referenzen
Eigenschaften und Eigenschaften der Carbonylgruppe
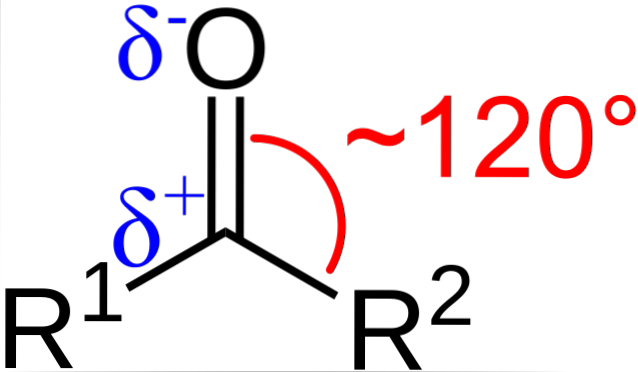
Was sind die strukturellen und elektronischen Eigenschaften der Carbonylgruppe? Oben ist zu sehen, jetzt mit den Buchstaben R.1 und R.zwei anstelle von A und B gibt es einen Winkel von 120 ° C zwischen den Substituenten und dem Sauerstoffatom; Das heißt, die Geometrie um diese Gruppe ist eine trigonale Ebene.
Damit eine solche Geometrie vorliegt, müssen die Kohlenstoff- und Sauerstoffatome notwendigerweise eine sp-chemische Hybridisierung aufweisenzwei;; Somit hat Kohlenstoff drei sp-Orbitalezwei einfache kovalente Bindungen mit R zu bilden1 und R.zwei, und ein Orbital p rein, um die Doppelbindung mit Sauerstoff herzustellen.
Dies erklärt, wie es zu einer C = O-Doppelbindung kommen kann.
Wenn das Bild beobachtet wird, ist auch zu sehen, dass Sauerstoff eine höhere Elektronendichte δ- als Kohlenstoff δ + aufweist. Dies liegt an der Tatsache, dass Sauerstoff elektronegativer als Kohlenstoff ist und ihn daher der Elektronendichte "beraubt"; und nicht nur er, sondern auch die R-Substituenten1 und R.zwei.
Folglich wird ein permanentes Dipolmoment erzeugt, das abhängig von der Molekülstruktur mehr oder weniger groß sein kann. Wo immer es eine Carbonylgruppe gibt, gibt es Dipolmomente.
Resonanzstrukturen
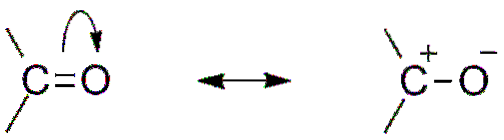
Eine weitere Folge der Elektronegativität von Sauerstoff ist, dass es in der Carbonylgruppe Resonanzstrukturen gibt, die einen Hybrid definieren (die Kombination der beiden Strukturen im oberen Bild). Beachten Sie, dass das Elektronenpaar in Richtung Orbital wandern kann p Sauerstoff, der das Kohlenstoffatom mit einer positiven Teilladung verlässt; eine Carbokation.
Beide Strukturen folgen ständig aufeinander, so dass Kohlenstoff einen konstanten Elektronenmangel aufrechterhält. Das heißt, für Kationen, die sehr nahe daran sind, erfahren sie eine elektrostatische Abstoßung. Wenn es sich jedoch um ein Anion oder eine Spezies handelt, die Elektronen abgeben kann, werden Sie eine starke Anziehungskraft für diesen Kohlenstoff spüren..
Dann tritt der sogenannte nukleophile Angriff auf, der in einem zukünftigen Abschnitt erläutert wird.
Nomenklatur
Wenn eine Verbindung die Gruppe C = O hat, spricht man von Carbonyl. Abhängig von der Art der Carbonylverbindung hat sie daher ihre eigenen Nomenklaturregeln.
Unabhängig davon, was es ist, haben alle eine gemeinsame Regel: C = O hat bei der Auflistung der Kohlenstoffatome Vorrang in der Kohlenstoffkette.
Dies bedeutet, dass bei Verzweigungen, Halogenatomen, stickstoffhaltigen funktionellen Gruppen, Doppel- oder Dreifachbindungen keine von ihnen eine Lokalisierungszahl von weniger als C = O tragen kann; Daher beginnt die längste Kette so nahe wie möglich an der Carbonylgruppe aufzuzählen.
Wenn andererseits mehrere C = O in der Kette vorhanden sind und eines von ihnen Teil einer höheren funktionellen Gruppe ist, trägt die Carbonylgruppe einen größeren Locator und wird als Oxosubstituent erwähnt..
Und was ist diese Hierarchie? Folgendes vom höchsten zum niedrigsten:
-Carbonsäuren, RCOOH
-Ester, RCOOR '
-Amida, RCONHzwei
-Aldehyd, RCOH (oder RCHO)
-Keton, RCOR
Wenn R und R 'für molekulare Segmente eingesetzt werden, entstehen unzählige Carbonylverbindungen, die durch die obigen Familien dargestellt werden: Carbonsäuren, Ester, Amide usw. Jedem ist seine traditionelle oder IUPAC-Nomenklatur zugeordnet..
Reaktivität
Nucleophiler Angriff
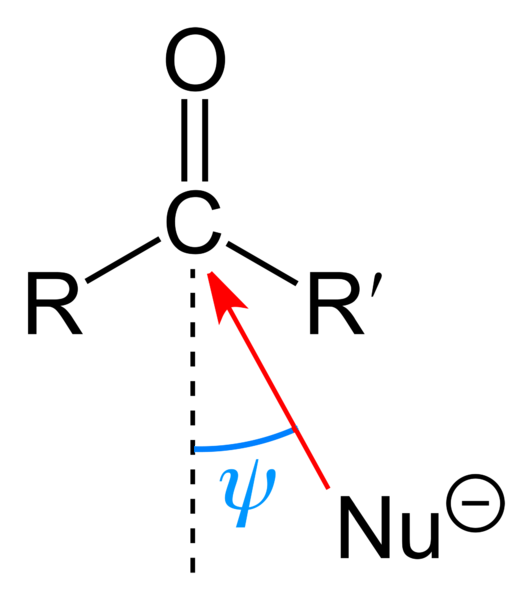
Das obere Bild zeigt den nukleophilen Angriff der Carbonylgruppe. Das Nucleophil Nu-, es kann ein Anion oder eine neutrale Spezies mit verfügbaren Elektronenpaaren sein; wie Ammoniak, NH3, beispielsweise. Es sucht ausschließlich nach Kohlenstoff, da es laut Resonanzstrukturen eine positive Teilladung aufweist.
Positive Ladung zieht Nu an-, die versuchen wird, durch eine "Flanke" so zu approximieren, dass es die geringste sterische Hinderung durch die R- und R'-Substituenten gibt. Je nachdem, wie voluminös sie sind oder wie groß die Nu ist-, der Angriff erfolgt unter verschiedenen Winkeln ψ; kann sehr offen oder geschlossen sein.
Sobald der Angriff erfolgt ist, wird eine Zwischenverbindung gebildet, Nu-CRR'-O-;; Das heißt, Sauerstoff bleibt mit einem Elektronenpaar zurück, damit Nu hinzugefügt werden kann- Carbonylgruppe.
Dieser negativ geladene Sauerstoff kann in andere Reaktionsschritte eingreifen; als Hydroxylgruppe protoniert, OH oder als Wassermolekül freigesetzt.
Die beteiligten Mechanismen sowie die durch diesen Angriff erhaltenen Reaktionsprodukte sind sehr unterschiedlich..
Derivate
Das nukleophile Mittel Nu- Es können viele Arten sein. Für jedes einzelne entstehen bei der Reaktion mit der Carbonylgruppe unterschiedliche Derivate.
Wenn beispielsweise das nukleophile Mittel ein Amin ist, ist NHzweiR, Imine entstehen, R.zweiC = NR; wenn es Hydroxylamin ist, NHzweiOH führt zu Oximen, RR'C = NOH; wenn es das Cyanidanion ist, CN-, Cyanhydrine werden produziert, RR'C (OH) CN und so weiter mit anderen Spezies.
Die Ermäßigung
Zuerst wurde gesagt, dass diese Gruppe sauerstoffhaltig und daher oxidiert ist. Dies bedeutet, dass es unter den gegebenen Bedingungen reduziert werden kann oder Bindungen mit dem Sauerstoffatom verlieren kann, indem es durch Wasserstoff ersetzt wird. Beispielsweise:
C = O => CHzwei
Diese Umwandlung zeigt an, dass die Carbonylgruppe zu einer Methylengruppe reduziert wurde; Durch den Sauerstoffverlust wurde Wasserstoff gewonnen. In geeigneterer chemischer Hinsicht: Die Carbonylverbindung wird zu einem Alkan reduziert.
Wenn es sich um ein Keton handelt, RCOR ', in Gegenwart von Hydrazin, H.zweiN-NHzwei, und ein stark basisches Medium kann zu seinem jeweiligen Alkan reduziert werden; Diese Reaktion ist als Wolff-Kishner-Reduktion bekannt:
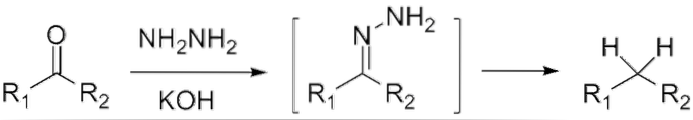
Wenn das Reaktionsgemisch andererseits aus amalgamiertem Zink und Salzsäure besteht, spricht man von einer Clemmensen-Reduktion:
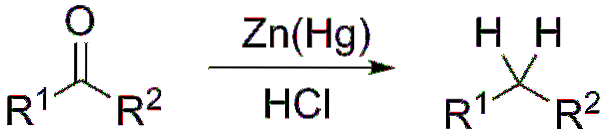
Bildung von Acetalen und Ketalen
Die Carbonylgruppe kann nicht nur nukleophile Mittel Nu hinzufügen-, Unter sauren Bedingungen kann es aber auch über ähnliche Mechanismen mit Alkoholen reagieren.
Wenn ein Aldehyd oder Keton teilweise mit einem Alkohol reagiert, entstehen Hemiacetale bzw. Hemicetale. Wenn die Reaktion abgeschlossen ist, sind die Produkte Acetale und Ketale. Die folgenden chemischen Gleichungen fassen zusammen und verdeutlichen, was gerade erwähnt wurde:
RCHO + R.3OH g RCHOH (OR3) (Hemiacetal) + R.4OH g RCH (OR3) (ODER4) (Acetal)
RCORzwei + R.3OH g RCORzwei(OH) (OR3) (Hemiketal) + R.4OH g RCORzwei(ODER3) (ODER4) (Ketal)
Die erste Reaktion entspricht der Bildung von Halbacetalen und Acetalen aus einem Aldehyd und die zweite von Hemicetalen und Ketalen aus einem Keton.
Diese Gleichungen sind möglicherweise nicht einfach genug, um die Bildung dieser Verbindungen zu erklären. Für eine erste Annäherung an das Thema reicht es jedoch zu verstehen, dass Alkohole zugesetzt werden und dass ihre Seitenketten R (R.3 und R.4) an Carbonylkohlenstoff gebunden werden. Deshalb werden ODER hinzugefügt3 und ODER4 zum Ausgangsmolekül.
Der Hauptunterschied zwischen einem Acetal und einem Ketal ist das Vorhandensein des an den Kohlenstoff gebundenen Wasserstoffatoms. Beachten Sie, dass dem Keton dieser Wasserstoff fehlt.
Typen
Sehr ähnlich wie im Abschnitt zur Nomenklatur für die Carbonylgruppe erläutert, sind ihre Typen eine Funktion, von der die Substituenten A und B oder R und R 'abhängen. Daher gibt es strukturelle Eigenschaften, die eine Reihe von Carbonylverbindungen gemeinsam haben, die über die Reihenfolge oder Art der Bindungen hinausgehen..
Beispielsweise wurde zu Beginn der Analogie zwischen dieser Gruppe und Kohlenmonoxid C≡O erwähnt. Wenn das Molekül keine Wasserstoffatome enthält und es auch zwei terminale C = O gibt, ist es ein Kohlenoxid C.nODERzwei. Für n gleich 3 haben wir:
O = C = C = C = O.
Das ist, als ob zwei C≡O-Moleküle durch einen Kohlenstoff verbunden und getrennt wären.
Carbonylverbindungen können nicht nur aus CO-Gas, sondern auch aus Kohlensäure H abgeleitet werdenzweiCO3 oder OH- (C = O) -OH. Hier stellen die beiden OH R und R 'dar, und wenn entweder einer von ihnen oder ihre Wasserstoffatome ersetzt werden, werden Derivate der Kohlensäure erhalten.
Und dann gibt es die Derivate der Carbonsäuren RCOOH, die durch Ändern der Identität von R oder Ersetzen eines anderen Atoms oder einer anderen Kette R 'durch H erhalten werden (wodurch ein Ester RCOOR' entstehen würde)..
Wie man es in Aldehyden und Ketonen identifiziert
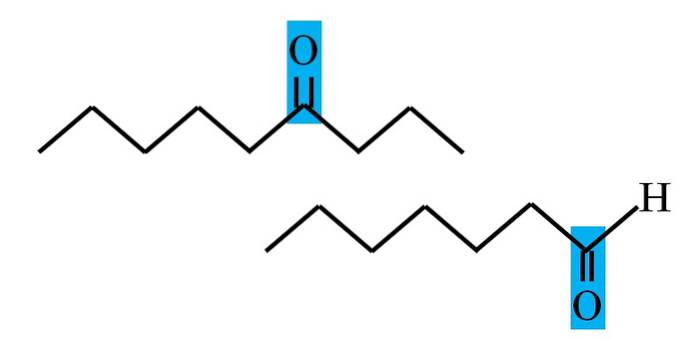
Sowohl Aldehyde als auch Ketone haben das Vorhandensein der Carbonylgruppe gemeinsam. Seine chemischen und physikalischen Eigenschaften sind darauf zurückzuführen. Ihre molekularen Umgebungen sind jedoch in beiden Verbindungen nicht gleich; im ersteren befindet es sich in einer Endposition und im letzteren irgendwo in der Kette.
Im obigen Bild befindet sich die Carbonylgruppe beispielsweise in einem blauen Kästchen. Bei Ketonen muss sich neben dieser Box ein weiteres Kohlenstoff- oder Kettensegment befinden (oben). In Aldehyden kann es nur ein Wasserstoffatom geben (unten)..
Wenn C = O an einem Ende der Kette ist, ist es ein Aldehyd; Das ist der direkteste Weg, um es von einem Keton zu unterscheiden.
ICH WÜRDE
Aber woher wissen Sie experimentell, ob eine unbekannte Verbindung ein Aldehyd oder ein Keton ist? Es gibt zahlreiche Methoden, von spektroskopischen (Absorption von Infrarotstrahlung, IR) bis zu qualitativen organischen Tests.
In Bezug auf qualitative Tests basieren diese auf Reaktionen, bei denen der Analytiker, wenn er positiv ist, eine physikalische Reaktion beobachtet. Farbveränderung, Wärmeabgabe, Blasenbildung etc..
Zum Beispiel bei Zugabe einer sauren Lösung von K.zweiCrzweiODER7 Der Aldehyd ändert sich in Carbonsäure, wodurch sich die Farbe der Lösung von orange nach grün ändert (positiver Test). Währenddessen reagieren die Ketone nicht und daher beobachtet der Analytiker keine Farbänderung (negativer Test).
Ein weiterer Test besteht aus der Verwendung des Tollens-Reagens [Ag (NH3)zwei]]+, damit der Aldehyd Ag-Kationen reduziert+ zu metallischem Silber. Und das Ergebnis: die Bildung eines silbernen Spiegels am Boden des Reagenzglases, in dem die Probe platziert wurde..
Hauptbeispiele
Schließlich wird eine Reihe von Beispielen für Carbonylverbindungen aufgeführt:
-CH3COOH, Essigsäure
-HCOOH, Ameisensäure
-CH3Wagen3, Propanon
-CH3WagenzweiCH3, 2-Butanon
-C.6H.5Wagen3, Acetophenon
-CH3CHO, Ethanal
-CH3CHzweiCHzweiCHzweiCHO, Pentanal
-C.6H.5CHO, Benzaldehyd
-CH3CONHzwei, Acetamid
-CH3CHzweiCHzweiCOOCH3, Propylacetat
Wenn nun Beispiele für Verbindungen angeführt werden, die einfach diese Gruppe besitzen, würde die Liste fast endlos werden.
Verweise
- Morrison, R. T. und Boyd, R., N. (1987). Organische Chemie. 5. Auflage. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Graham Solomons T. W., Craig B. Fryhle. (2011). Organische Chemie. Amine. (10. Auflage). Wiley plus.
- Reid Danielle. (2019). Carbonylgruppe: Eigenschaften & Übersicht. Studie. Wiederhergestellt von: study.com
- Sharleen Agvateesiri. (05. Juni 2019). Die Carbonylgruppe. Chemie LibreTexts. Wiederhergestellt von: chem.libretexts.org
- Wiki Kids Ltd. (2018). Carbonylverbindungen. Wiederhergestellt von: simply.science
- Toppr. (s.f.). Nomenklatur und Struktur der Carbonylgruppe. Wiederhergestellt von: toppr.com
- Clark J. (2015). Oxidation von Aldehyden und Ketonen. Wiederhergestellt von: chemguide.co.uk



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.