
GLUT1 Eigenschaften, Struktur, Funktionen

GLUT1 ist ein Transmembranprotein, das den passiven Transport von Glucose durch die Plasmamembran vom extrazellulären Raum zum Inneren der Zelle erleichtert.
Zusätzlich zu Glucose wurde gezeigt, dass es auch andere sechs Kohlenstoffzucker wie Galactose, Glucosamin und Mannose mobilisieren kann. Dies ermöglicht wiederum die Aufnahme und den Transport von Vitamin C in das Innere von Zellen, die es nicht produzieren können..
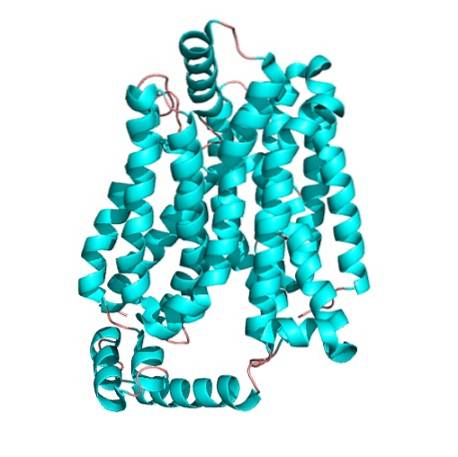
Da alle von GLUT1 transportierten Moleküle an den Energieerzeugungswegen in der Zelle beteiligt sind, spielt die Expression dieses Transporters eine sehr wichtige metabolische Rolle..
Tatsächlich führen Mutationen, die die Expression eines funktionellen GLUT1 verändern oder aufheben, zum Auftreten zahlreicher Krankheiten, die mit einer langsamen neurologischen Entwicklung und einem begrenzten Gehirnwachstum verbunden sind.
Artikelverzeichnis
- 1 Glukosetransport in Zellen und GLUT1-Transportern
- 2 Funktionen von GLUT1
- 3 Struktur von GLUT 1
- 3.1 Eine Änderung der Struktur von GLUT1 bestimmt den Transport von Glucose in die Zelle
- 4 GLUT 1-Funktionen
- 5 Referenzen
Glukosetransport in Zellen und GLUT1-Transportern
Glukose ist die bevorzugte Kohlenstoff- und Energiequelle für die meisten Zellen, aus denen der Baum des Lebens besteht. Da es nicht klein genug und hydrophob ist, um Zellmembranen selbst zu durchqueren, erfordert sein Transport in die Zelle die Hilfe von Transporterproteinen..
Für diesen Zucker wurden zwei spezifische Transporter-vermittelte Transportmechanismen vorgeschlagen. Einer von ihnen reagiert auf ein passives Transportsystem (erleichterte Diffusion) und der zweite auf ein aktives Transportsystem..
Die erste erfordert keine Energieausführung und erfolgt durch einen Konzentrationsgradienten, dh von einem Ort mit hoher Glukosekonzentration zu einem Ort, an dem die Konzentration niedriger ist..
Der aktive Glucosetransport wird von Transportern durchgeführt, die Energie aus dem Natriumionen-Co-Transport erhalten.
Im Gegensatz dazu wird die erleichterte (passive) Diffusion von Glucose von einer Familie von torähnlichen Transportern namens GLUT durchgeführt (für das englische Akronym von „Glukosetransporter ”), Familie, zu der GLUT1 gehört. Diese binden Glukose an der Außenseite der Zelle und transportieren sie zum Cytosol. Mindestens 5 von ihnen wurden identifiziert und ihre Verteilung scheint in verschiedenen Säugetiergeweben unterschiedlich zu sein..
GLUT1-Funktionen
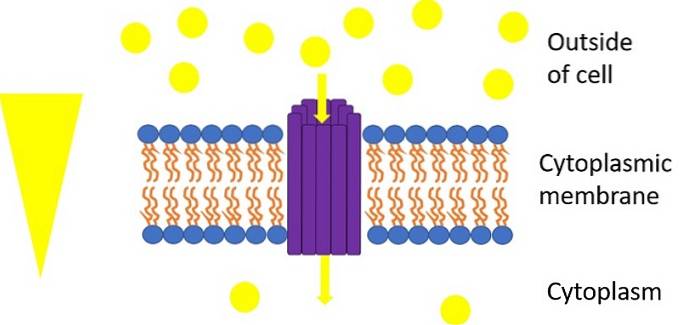
GLUT1 ist ein Uniporter-Glukosetransporter, der den Transport von Glukose in nur einer Richtung von der Außenseite der Zelle zum Cytosol durchführen kann.
Es gehört zur Superfamilie der erleichterten Diffusionstransporter (MSF), die in vielen verschiedenen Organismen weit verbreitet ist. Es ist auch am Transmembrantransport einer großen Anzahl kleiner organischer Moleküle beteiligt..
Seine Peptidsequenz von 492 Aminosäuren ist in den verschiedenen Organismen, in denen es identifiziert wurde, hoch konserviert, was nicht schwer zu glauben ist, da die Verwendung von Glucose zur Energiegewinnung das Zentrum des Stoffwechselbaums des Lebens darstellt..
Struktur von GLUT 1
GLUT1 ist ein integrales Multipass-Membranprotein, das aus 492 Aminosäureresten besteht. Diese Art von integralen Membranproteinen ist dadurch gekennzeichnet, dass die Lipiddoppelschicht mehrmals gekreuzt wird.
Die dreidimensionale chemische Struktur von Proteinen wird im Allgemeinen durch Röntgenkristallographie bestimmt. Letztere ist eine Technik, die von Biochemikern häufig verwendet wird, um ein Strukturmodell unter Verwendung reiner Kristalle des zu untersuchenden Proteins zu rekonstruieren..
Für hochkonservierte Proteine wie GLUT1 kann die Bestimmung der Proteinstruktur eines einzelnen Organismus ausreichend sein. Aus diesem Grund haben Forscher bisher die GLUT1-Kristallstruktur der Mutante E3229 bestimmt..
Wie bei allen anderen Mitgliedern der Major Facilitator Superfamily (MSF) wird die Struktur von GLUT1 durch 12 Transmembranhelices dargestellt..
Zusätzlich sind in GLUT1 E3229 die Amino- und Carboxyl-terminalen Enden des Peptids pseudosymmetrisch und auf das Cytosol ausgerichtet. Die Anordnung dieser Enden erzeugt eine Tasche oder einen Hohlraum, der innerhalb der Zelle offen ist und die Bindungsstelle für Glucose bildet..
Eine Änderung der Struktur von GLUT1 bestimmt den Transport von Glucose in die Zelle
Da Glucose im Allgemeinen von außen nach innen transportiert wird, führt die Feststellung, dass die Bindungsstelle für diesen Zucker auf das Cytosol ausgerichtet ist, zu Verwirrung.
Diese Verwirrung findet jedoch eine Lösung in den Ergebnissen biochemischer Untersuchungen, die darauf hindeuten, dass eine Änderung in der Form des Proteins auftritt, wodurch die Glucosebindungsstelle zuerst auf einer Seite der Membran und dann auf der anderen freigelegt werden kann..
Dies bedeutet nicht, dass sich das Protein durch die Membran dreht, sondern dass die Bindung des Zuckers die Veränderung so einleitet, dass die Glukose wie ein Tor dem Inneren ausgesetzt wird.
GLUT 1 Funktionen
Da GLUT1 ein konstitutiver Expressionstransporter ist, dh in den meisten Säugetierzellen immer exprimiert wird, sind die Funktionen, die es ausführt, für diese Zellen von entscheidender Bedeutung. Tatsächlich wird es in fast allen Geweben des Fötus exprimiert, gerade weil während der Entwicklungsphasen eine hohe Energieversorgung erforderlich ist, um das Wachstum sicherzustellen..
Seine Expression ist jedoch nach der Geburt in einigen Geweben wie der Leber verringert, wo die Expression anderer Isoformen wie GLUT4 jetzt erhöht ist..
Für Erythrozyten ist dies von grundlegender Bedeutung, da letztere ausschließlich von Glukose als Energiequelle abhängen, da ihnen Mitochondrien fehlen. Es ist jedoch weiterhin für die Aufnahme von Glukose verantwortlich, um die Atmung in den übrigen Zelltypen aufrechtzuerhalten.
Da GLUT1 in den Gefäßendothelzellen vieler Organe und Gewebe eine hohe Konzentration erreicht, besteht eine seiner Funktionen darin, Glukose aus dem Blut zu transportieren.
Der Transport anderer Hexosen wie Mannose, Galactose und Glucosamin durch GLUT1 stellt seine direkte Beziehung zum Energiestoffwechsel nicht in Frage, da aus all diesen Hexosen ATP erzeugt werden kann.
Darüber hinaus war die Aufnahme und der Transport von Vitamin C in Zellen, die es nicht synthetisieren können, eine der Funktionen, über die für diesen allgegenwärtigen Rezeptor berichtet wurde.
Verweise
- Chen LY, Phelix CF. Extrazelluläres Gating des Glukosetransports durch GLUT 1. Biochem Biophys Res Commun. 2019; 511 (3): 573 & ndash; 578.
- Cunningham P, Naftalin RJ. Auswirkungen des aberranten temperaturempfindlichen Glukosetransports über die Glukosetransporter-Mangelmutante (GLUT1DS) T295M für die Transportmodelle mit alternativem Zugang und festem Standort. J Membr Biol. 2013; 246 (6): 495 & ndash; 511.
- Deng D, Xu C, Sun P, Wu J, Yan C, Hu M, Yan N. Kristallstruktur des menschlichen Glucosetransporters GLUT1. Natur. 2014; 510 (7503): 121 & ndash; 125.
- Deng D, Yan N. Kristallisation und Strukturbestimmung der menschlichen Glucosetransporter GLUT1 und GLUT3. Methods Mol Biol. 2018; 1713: 15-29.
- Fu X, Zhang G, Liu R, Wei J, Zhang-Negrerie D, Jian X, Gao Q. Mechanistische Untersuchung des durch GLUT1 vermittelten menschlichen Glukosetransports. J Chem Inf Model. 2016; 56 (3): 517 & ndash; 526.
- Mückler M, Makepeace C. Analyse des Transmembransegments 8 des GLUT1-Glucosetransporters durch Cystein-Scanning-Mutagenese und Zugänglichkeit von substituiertem Cystein. J Biol Chem. 2004; 279 (11): 10494 & ndash; 10499.
- Philip L. Kapitel 13 - Membrantransport. Die Membranen der Zellen (dritte Ausgabe). 2016, S. 335–378.
- Simmons R. Zell-Glukosetransport und Glukose-Handling während der fetalen und neonatalen Entwicklung. Fetale und neonatale Physiologie (5. Auflage). 2017; 1 S. 428-435.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.