
Gaseigenschaften, Verhalten, Form, Beispiele

Das Gase Dies sind alle Substanzen oder Verbindungen, deren Aggregatzustände schwach und dispergiert sind und gleichzeitig stark von den Druck- und Temperaturbedingungen abhängen, die sie bestimmen. Sie sind nach Plasma vielleicht die zweithäufigste Form von Materie im gesamten Universum..
Auf der Erde bilden Gase die Schichten der Atmosphäre, von der Exosphäre über die Troposphäre bis hin zur Luft, die wir atmen. Obwohl ein Gas unsichtbar ist, wenn es durch große Räume wie den Himmel diffundiert, wird es durch die Bewegung von Wolken, die Windungen einer Mühle oder durch die Dämpfe, die in kalten Klimazonen aus unserem Mund ausgeatmet werden, erfasst..

In Bezug auf die negativen Umweltaspekte wird dies auch im schwarzen Rauch aus den Auspuffrohren der Fahrzeuge, in den Rauchsäulen der Türme in den Fabriken oder im Rauch beobachtet, der beim Verbrennen eines Waldes entsteht.
Sie sind auch gasförmigen Phänomenen ausgesetzt, wenn Sie Dämpfe sehen, die aus den Abwasserkanälen austreten, in den Sümpfen und Friedhöfen, in den Blasen in den Aquarien, in den Heliumballons, die in den Himmel freigesetzt werden, in dem von Pflanzen freigesetzten Sauerstoff als Ergebnis ihrer Photosynthese und sogar bei Aufstoßen und Blähungen.
Wo immer Gase beobachtet werden, bedeutet dies, dass eine chemische Reaktion stattgefunden hat, es sei denn, sie werden direkt aus der Luft fixiert oder assimiliert, der Hauptquelle für Gase (oberflächlich) auf dem Planeten. Bei steigenden Temperaturen wandeln sich alle Substanzen (chemische Elemente) in Gase um, einschließlich Metalle wie Eisen, Gold und Silber..
Unabhängig von der chemischen Natur der Gase teilen sie alle gemeinsam die große Entfernung, die ihre Partikel (Atome, Moleküle, Ionen usw.) voneinander trennt, die sich chaotisch und willkürlich durch ein bestimmtes Volumen oder einen bestimmten Raum bewegen..
Artikelverzeichnis
- 1 Eigenschaften von Gasen
- 1.1 Physisch
- 1.2 Elektrische und thermische Leitfähigkeit
- 1.3 Reaktivität
- 2 Verhalten von Gasen
- 3 Form von Gasen
- 4 Druck eines Gases
- 4.1 Einheiten
- 5 Volumen eines Gases
- 6 Hauptgasgesetze
- 6.1 Boyles Gesetz
- 6.2 Charles Law
- 6.3 Gay-Lussacs Gesetz
- 6.4 Avogadro-Gesetz
- 7 Arten von Gasen
- 7.1 Brennbare Gase
- 7.2 Industriegase
- 7.3 Inertgase
- 8 Beispiele für gasförmige Elemente und Verbindungen
- 8.1 Gasförmige Verbindungen
- 9 Referenzen
Eigenschaften von Gasen
Körperlich
Die physikalischen Eigenschaften von Gasen variieren je nachdem, um welche Substanz oder Verbindung es sich handelt. Gase sind im Allgemeinen mit schlechten Gerüchen oder Fäulnis verbunden, entweder aufgrund ihres Schwefelgehalts oder aufgrund des Vorhandenseins flüchtiger Amine. Ebenso werden sie mit grünlichen, braunen oder gelblichen Färbungen dargestellt, die einschüchtern und ein schlechtes Omen geben.
Die meisten Gase oder zumindest die am häufigsten vorkommenden sind jedoch tatsächlich farblos und geruchlos. Obwohl sie schwer fassbar sind, sind sie auf der Haut zu spüren und widerstehen Bewegungen. Sie bilden sogar viskose Schichten auf den Körpern, die sie passieren (wie dies bei Flugzeugen der Fall ist)..
Alle Gase können Druck- oder Temperaturänderungen unterliegen, die sie in ihre jeweiligen Flüssigkeiten verwandeln. Das heißt, sie leiden unter Kondensation (wenn sie abgekühlt sind) oder Verflüssigung (wenn sie "gepresst" werden)..

Andererseits können sich Gase in Flüssigkeiten und einigen porösen Feststoffen (wie Aktivkohle) lösen. Die Blasen sind das Ergebnis von Ansammlungen von Gasen, die sich noch nicht im Medium gelöst haben und zur Oberfläche der Flüssigkeit entweichen..
Elektrische und thermische Leitfähigkeit
Unter normalen Bedingungen (ohne Ionisierung ihrer Partikel) sind Gase schlechte Wärme- und Stromleiter. Wenn sie jedoch mit vielen Elektronen belastet sind, lassen sie Strom durch sie fließen, wie dies bei Blitzen während Stürmen der Fall ist..
Andererseits leuchten bei niedrigem Druck und unter Einwirkung eines elektrischen Feldes einige Gase, insbesondere die edlen oder perfekten, auf und ihre Lichter werden für die Gestaltung von Werbung und Nachtplakaten (Neonlicht) sowie in der berühmte elektrische Entladungslampen in Straßenlaternen.
In Bezug auf die Wärmeleitfähigkeit verhalten sich viele Gase wie Wärmeisolatoren, so dass ihre Einbeziehung in die Füllung von Fasern, Geweben oder Glasscheiben dazu beiträgt, den Durchtritt von Wärme zu verhindern und die Temperatur konstant zu halten..
Es gibt jedoch Gase, die gute Wärmeleiter sind und schlimmere Verbrennungen verursachen können als solche, die durch Flüssigkeiten oder Feststoffe verursacht werden. Zum Beispiel wie bei heißem Dampf aus gebackenen Cupcakes (oder Empanadas) oder aus Dampfstrahlen, die aus Kesseln entweichen.
Reaktivität
Im Allgemeinen werden Reaktionen, an denen Gase beteiligt sind oder wo sie auftreten, als gefährlich und umständlich eingestuft.
Ihre Reaktivität hängt wiederum von ihrer chemischen Natur ab; Wenn jedoch mit Leichtigkeit expandiert und mobilisiert wird, muss mehr Sorgfalt und Kontrolle angewendet werden, da sie drastische Druckanstiege auslösen können, die die Struktur des Reaktors gefährden. ganz zu schweigen davon, wie brennbar oder nicht glückselig Gase sind.
Verhalten von Gasen
Makroskopisch kann man sich ein Bild über das Verhalten von Gasen machen, indem man beobachtet, wie sich Rauch, Ringe oder die literarischen "Zungen" von Zigaretten in der Luft entwickeln. Wenn eine Rauchgranate explodiert, ist es ebenfalls interessant, die Bewegung dieser verschiedenfarbigen Wolken detailliert darzustellen.
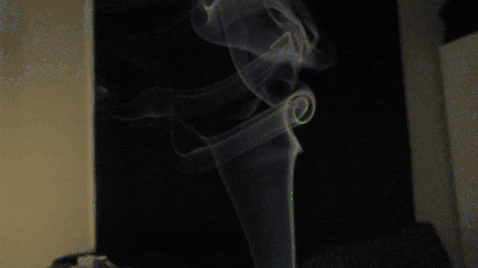
Solche Beobachtungen unterliegen jedoch der Einwirkung der Luft und auch der Tatsache, dass sehr feine feste Partikel im Rauch suspendiert sind. Daher reichen diese Beispiele nicht aus, um eine Schlussfolgerung hinsichtlich des tatsächlichen Verhaltens eines Gases zu ziehen. Stattdessen wurden Experimente durchgeführt und die kinetische Theorie der Gase entwickelt..
Molekular und idealerweise kollidieren gasförmige Partikel elastisch miteinander und weisen lineare, rotatorische und vibratorische Verschiebungen auf. Ihnen ist eine durchschnittliche Energie zugeordnet, die es ihnen ermöglicht, sich frei durch jeden Raum zu bewegen, ohne mit zunehmendem Volumen um sie herum fast zu interagieren oder mit einem anderen Teilchen zu kollidieren..
Sein Verhalten würde eine Mischung aus der unberechenbaren Brownschen Bewegung und den Kollisionen einiger Billardkugeln sein, die unaufhörlich zwischeneinander und den Wänden des Tisches hüpfen. Wenn es keine Wände gibt, diffundieren sie gegen unendlich, es sei denn, sie werden durch eine Kraft zurückgehalten: die Schwerkraft.
Form von Gasen
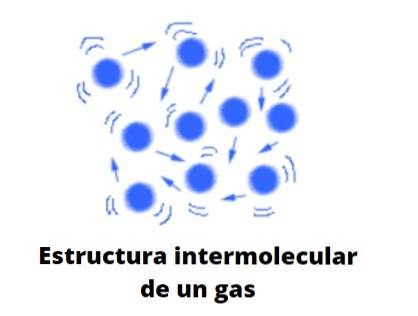
Im Gegensatz zu Flüssigkeiten und Feststoffen handelt es sich bei Gasen nicht um kondensierte Gase. Das heißt, die Aggregation oder Kohäsion seiner Partikel schafft es nie, eine Form zu definieren. Sie teilen mit Flüssigkeiten die Tatsache, dass sie das Volumen des Behälters, der sie enthält, vollständig einnehmen; Es fehlt ihnen jedoch die Oberfläche und die Oberflächenspannung.
Wenn die Gaskonzentration hoch ist, können ihre „Zungen“ oder die bereits beschriebenen makroskopischen Formen mit bloßem Auge gesehen werden. Diese werden früher oder später durch die Einwirkung des Windes oder durch die bloße Ausdehnung des Gases verschwinden. Die Gase bedecken daher alle Ecken des begrenzten Raums, wodurch hoch homogene Systeme entstehen.
Nun betrachtet die Theorie Gase bequemerweise als Kugeln, die kaum mit sich selbst kollidieren; aber wenn sie es tun, springen sie elastisch.
Diese Kugeln sind weit voneinander entfernt, so dass die Gase praktisch "voll" von Vakuum sind; daher seine Vielseitigkeit, durch den kleinsten Schlitz oder Spalt zu gehen, und die Leichtigkeit, sie signifikant komprimieren zu können.
Egal wie geschlossen eine Bäckerei ist, wenn Sie daneben gehen, können Sie sicher sein, dass Sie das Aroma von frisch gebackenem Brot genießen werden..
Druck eines Gases
Es könnte angenommen werden, dass die Kugeln oder Partikel des Gases, weil sie so dispergiert und getrennt sind, keinen Druck auf die Körper oder Gegenstände ausüben können. Die Atmosphäre beweist jedoch, dass ein solcher Glaube falsch ist: Sie hat Masse, Gewicht und verhindert, dass Flüssigkeiten aus dem Nichts verdampfen oder kochen. Siedepunkte werden bei atmosphärischem Druck gemessen.
Der Gasdruck wird quantifizierbarer, wenn Manometer verfügbar sind oder wenn sie in Behältern mit nicht verformbaren Wänden eingeschlossen sind. Je mehr Gaspartikel sich im Behälter befinden, desto größer ist die Anzahl der Kollisionen zwischen ihnen und den Wänden des Behälters..
Wenn diese Teilchen mit den Wänden kollidieren, drücken sie sie, da sie eine Kraft ausüben, die proportional zu ihrer kinetischen Energie auf ihre Oberfläche ist. Es ist, als würden die idealen Billardkugeln gegen eine Wand geworfen; Wenn es viele gibt, die sie mit hoher Geschwindigkeit treffen, kann es sogar brechen.
Einheiten
Es gibt viele Einheiten, die Gasdruckmessungen begleiten. Einige der bekanntesten sind Millimeter Quecksilber (mmHg) wie Torr. Es gibt solche des internationalen Einheitensystems (SI), die den Pascal (Pa) in N / m definierenzwei;; und von ihm das Kilo (kPa), Mega (MPa) und Giga (GPa) Pascal.
Volumen eines Gases
Ein Gas nimmt das gesamte Volumen des Behälters ein und dehnt sich aus. Je größer der Behälter ist, desto größer ist auch das Gasvolumen. aber sowohl sein Druck als auch seine Dichte nehmen bei gleicher Partikelmenge ab.
Das Gas selbst hat andererseits ein assoziiertes Volumen, das nicht so sehr von seiner Natur oder Molekülstruktur abhängt (idealerweise), sondern von den Druck- und Temperaturbedingungen, die es bestimmen; das ist sein Molvolumen.
In der Realität variiert das Molvolumen von einem Gas zum anderen, obwohl die Variationen gering sind, wenn es sich nicht um große und heterogene Moleküle handelt. Zum Beispiel das Molvolumen von Ammoniak (NH3, 22.079 l / mol) bei 0 ºC und 1 atm unterscheidet sich von Helium (He, 22.435 l / mol).
Alle Gase haben ein Molvolumen, das sich in Abhängigkeit von P und T ändert, und egal wie groß ihre Partikel sind, ihre Anzahl ist immer gleich. Von hier leitete er tatsächlich das ab, was unter Avogadros Nummer bekannt ist (N.ZU).
Hauptgasgesetze
Das Verhalten von Gasen wird seit Jahrhunderten durch Experimente, eingehende Beobachtungen und Interpretation der Ergebnisse untersucht..
Solche Experimente ermöglichten es, eine Reihe von Gesetzen aufzustellen, die in derselben Gleichung (der idealen Gase) zusammengefasst sind und dazu beitragen, die Reaktionen eines Gases auf verschiedene Druck- und Temperaturbedingungen vorherzusagen. Auf diese Weise besteht eine Beziehung zwischen seinem Volumen, seiner Temperatur und seinem Druck sowie der Anzahl seiner Mol in einem gegebenen System..
Zu diesen Gesetzen gehören die folgenden vier: Boyle, Charles, Gay-Lussac und Avogadro.
Boyles Gesetz
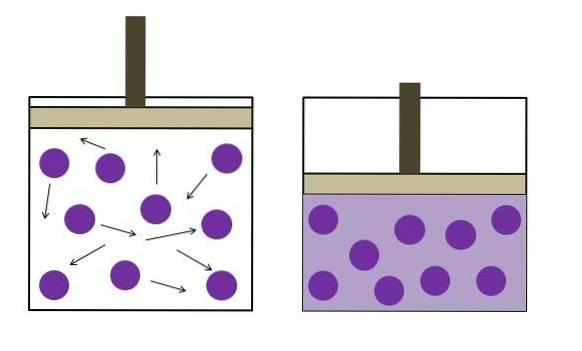
Das Boyle'sche Gesetz besagt, dass bei konstanter Temperatur das Volumen eines idealen Gases umgekehrt proportional zu seinem Druck ist; Das heißt, je größer der Behälter ist, desto geringer ist der Druck, den seine Wände aufgrund der gleichen Gasmenge erfahren..
Charles Law

Das Gesetz von Charles besagt, dass bei konstantem Druck das Volumen eines idealen Gases direkt proportional zu seiner Temperatur ist. Luftballons demonstrieren Charles 'Gesetz, denn wenn sie erhitzt werden, blasen sie sich etwas mehr auf, während sie, wenn sie in flüssigen Stickstoff getaucht sind, die Luft ablassen, weil sich das Volumen des Gases in ihnen zusammenzieht..
Gay-Lussac-Gesetz
Das Gesetz von Gay-Lussac besagt, dass bei konstantem Volumen der Druck eines idealen Gases direkt proportional zu seiner Temperatur ist. Wenn in einem gut geschlossenen Kessel ein Gas progressiv erhitzt wird, ist der Druck in ihm jedes Mal größer, da sich die Wände des Kessels nicht verformen oder ausdehnen. das heißt, sein Volumen ändert sich nicht, es ist konstant.
Avogadros Gesetz
Schließlich besagt das Avogadro-Gesetz, dass das von einem idealen Gas eingenommene Volumen direkt proportional zur Anzahl seiner Partikel ist. Wenn wir also ein Mol Partikel haben (6.02 · 102. 3) haben wir dann das Molvolumen des Gases.
Arten von Gasen
Brennbare Gase
Sie sind jene Gase, deren Bestandteile als Brennstoffe fungieren, weil sie zur Erzeugung von Wärmeenergie verwendet werden. Einige von ihnen sind Erdgas, Flüssiggas und Wasserstoff.
Industriegase
Hierbei handelt es sich um hergestellte Gase, die für verschiedene Zwecke und Anwendungen an die Öffentlichkeit vermarktet werden, z. B. für die Bereiche Gesundheit, Lebensmittel, Umweltschutz, Metallurgie, chemische Industrie und Sicherheit. Einige dieser Gase sind unter anderem Sauerstoff, Stickstoff, Helium, Chlor, Wasserstoff, Kohlenmonoxid, Propan, Methan, Lachgas..
Inertgase
Dies sind Gase, die unter bestimmten Temperatur- und Druckbedingungen keine chemische Reaktion oder eine sehr niedrige Reaktion hervorrufen. Sie sind Neon, Argon, Helium, Krypton und Xenon. Sie werden in chemischen Prozessen eingesetzt, bei denen nicht reaktive Elemente erforderlich sind.
Beispiele für gasförmige Elemente und Verbindungen
Was sind die gasförmigen Elemente des Periodensystems unter Erdbedingungen??
Wir haben zuerst Wasserstoff (H), der H-Moleküle bildetzwei. Helium (He), das leichteste Edelgas, folgt; und dann Stickstoff (N), Sauerstoff (O) und Fluor (F). Diese letzten drei bilden auch zweiatomige Moleküle: N.zwei, ODERzwei und F.zwei.
Nach Fluor kommt Neon (Ne), das Edelgas, das Helium folgt. Unterhalb von Fluor befindet sich Chlor (Cl) in Form von Cl-Molekülenzwei.
Als nächstes haben wir den Rest der Edelgase: Argon (Ar), Krypton (Kr), Xenon (Xe), Radon (Rn) und Oganeson (Og).
Sie sind also insgesamt zwölf gasförmige Elemente; elf, wenn wir das hochradioaktive und instabile Oganeson ausschließen.
Gasförmige Verbindungen
Zusätzlich zu gasförmigen Elementen werden einige gebräuchliche gasförmige Verbindungen aufgeführt:
-H.zweiJa, Schwefelwasserstoff, verantwortlich für den Geruch von faulen Eiern
-NH3, Ammoniak, das scharfe Aroma in gebrauchten Seifen
-COzwei, Kohlendioxid, ein Treibhausgas
-NICHTzwei, Stickstoffdioxid
-NO, Stickstoffmonoxid, ein Gas, von dem angenommen wurde, dass es hochtoxisch ist, aber eine wichtige Rolle im Kreislaufsystem spielt
-SW3, Schwefeltrioxid
-C.4H.10, Butan
-HCl, Chlorwasserstoff
-ODER3, Ozon
-SF6, Schwefelhexafluorid
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). CENGAGE Lernen.
- Die Eigenschaften von Gasen. Wiederhergestellt von: chemed.chem.purdue.edu
- Wikipedia. (2019). Gas. Wiederhergestellt von: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (5. Dezember 2018). Gase - Allgemeine Eigenschaften von Gasen. Wiederhergestellt von :oughtco.com
- Harvard Men's Health Watch. (2019). Der Zustand des Gases. Wiederhergestellt von: health.harvard.edu
- Elektronik-Kühl-Editoren. (1. September 1998). Die Wärmeleitfähigkeit von Gasen. Wiederhergestellt von: electronic-cooling.com


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.